Samenvatting
Het aantal patiënten met een gewrichtsprothese neemt wereldwijd toe. Een postoperatieve bacteriële infectie is een belangrijke complicatie, die in 0,5 tot 5 procent van de gevallen voorkomt. De behandeling van een geïnfecteerde gewrichtsprothese (periprosthetic joint infection, PJI) bestaat uit langdurige (deels of volledig intraveneuze) antimicrobiële therapie en is daarom een intensief multidisciplinair traject. De morbiditeit en maatschappelijke kosten zijn aanzienlijk: voorkomen is beter dan genezen. Profylactische strategieën zijn te verdelen in algemene maatregelen (hygiënisch werken) en meer gerichte maatregelen zoals S. aureus-dekolonisatie. Er zijn aanwijzingen dat S. aureus-dekolonisatie met name bij cardiothoracale en orthopedische ingrepen zinvol is. Cefazoline wordt door (inter)nationale richtlijnen geadviseerd als voorkeursmiddel voor systemische perioperatieve antibiotische profylaxe, met vancomycine of clindamycine als alternatieven bij allergie. De aanbevolen duur van profylaxe is in de laatste decennia verkort van enkele dagen naar een eenmalige gift of maximaal 24 uur postoperatief. Het voordeel van verlengde profylaxe is niet aangetoond, hoewel er signalen zijn dat het bij een geselecteerde populatie voordelig kan zijn. Antibiotica kunnen ook toegevoegd worden aan het cement, met lokale afgifte. Nader onderzoek is nodig om risicofactoren en -groepen te onderscheiden waarop profylactische maatregelen aangepast kunnen worden.
Abstract
The total number of joint prostheses being placed is increasing. Periprosthetic joint infection (PJI) is an important complication, with an incidence of 0.5 to 5 percent. Treatment of PJI contains long term (intravenously) antibiotic treatment, and therefore needs a multidisciplinary approach. Morbidity and costs are high: better to prevent than to cure.
Prophylactic strategies are described in the bundle approaches in international guidelines. Local antibiotic prophylaxis can be performed by nasal S. aureus decolonization. Some studies suggest reduction of infection after S. aureus decolonization. In international guidelines, cefazoline is the first choice agent of systemic prophylaxis. Vancomycin or clindamycin can be used as alternative agents in case of allergy. The recommended duration of systemic prophylaxis is shortened in the last decades from several days to a single dose, or maximal 24 hours after procedure. The benefit of prolonged antibiotic prophylaxis has not been proven yet, although some studies suggest a benefit for high risk patients. Besides systemic antimicrobial prophylaxis there also is a possibility to add antimicrobial agents to the cement. Future studies are needed to determine whether prophylactic strategies can be individualized.
Epidemiologie
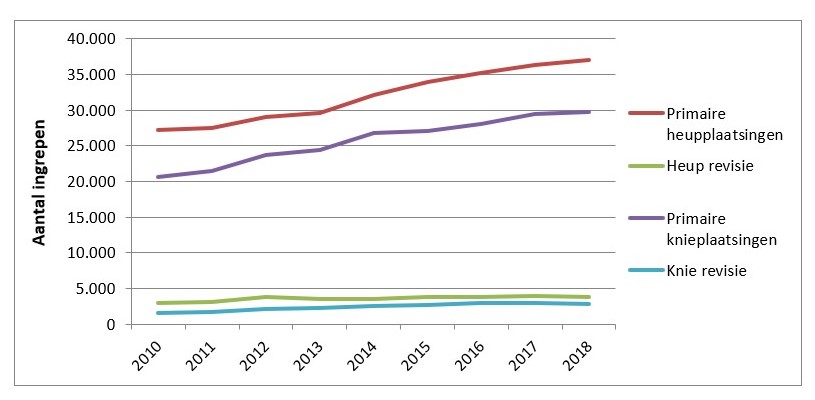
De Landelijke Registratie Orthopedische Implantaten (LROI) houdt een register bij van het aantal primaire plaatsingen en revisies van gewrichtsprothesen. Hieruit blijkt dat het aantal primaire plaatsingen van gewrichtsprothesen jaarlijks blijft toenemen. Zo werden er in 2018 in Nederland bijna 60.000 primaire heup- en knieprothesen geplaatst (figuur 1).
Nog eens 7000 revisies van heup- en knieprothesen werden verricht, waarvan 20 procent vanwege een infectie.[1] Dit percentage is een onderschatting, de registratie wordt namelijk gedaan op het moment van de operatie. De weefselkweken worden juist op dit moment afgenomen en de kweekresultaten zijn dus nog niet bekend tijdens de registratie. Dit betekent dat er geen registratie is van de onverwachte PJI. De registratie op basis van kweekuitslagen wordt nauwelijks achteraf gecorrigeerd. Het percentage onverwachte PJI bij vermeende aseptische revisies van heup- of knieprothese wordt geschat op 10 tot 15 procent.[2] Vroege postoperatieve wondinfecties (minder dan drie maanden na operatie) zijn vaak het gevolg van directe contaminatie van het wondgebied. Huidflora speelt hierbij een belangrijke rol. De registratie van de oorzakelijke verwekkers van PJI is niet dekkend; bij de geregistreerde gevallen wordt het meest grampositieve huidflora (Staphylococcus spp., Cutibacterium acnes) aangetroffen als verwekker van PJI. Uit internationale literatuur blijkt dat er onder de verwekkers van PJI een toenemende incidentie is van multiresistente micro-organismen of gramnegatieve micro-organismen. Vooralsnog zijn er geen sterke aanwijzingen om aan te nemen dat dit op de Nederlandse situatie van toepassing is.[3,4]
Risicofactoren
De risicofactoren voor het ontstaan van PJI zijn deels bekend, zoals ongecontroleerde diabetes mellitus en obesitas.[5] Er is echter nog veel onduidelijkheid en data over de invloed van gebruik van anticoagulantia, tourniquetgebruik (bloedleegte), immuunmodulerende medicatie, de mate van glucoseregulatie bij niet-diabeten en algehele versus spinale anesthesie zijn tegenstrijdig.[6,7] Er zijn echter nog onvoldoende gegevens beschikbaar om de invloed van mogelijke risicofactoren, zoals het gebruik van anticoagulantia of immuunmodulerende medicatie, opereren onder bloedleegte (tourniquetgebruik), mate van glucoseregulatie bij patiënten zonder diabetes mellitus en verschillende anesthesietechnieken (algeheel versus spinaal) te beoordelen. Het brede spectrum van verbeteren van de preoperatieve conditie van de patiënt, hygiënische en technische interventies in de operatiekamer en antibiotische profylaxe wordt in de internationale literatuur ook wel aangeduid met de term ‘bundle approach’. Aandacht en naleving van deze richtlijnen op zichzelf reduceert het aantal postoperatieve wondinfecties.[8] Deze bundels staan beschreven in algemene richtlijnen ter voorkomen van postoperatieve wondinfecties (POWI, SSI) van bijvoorbeeld de CDC en WHO, al dan niet gericht op de orthopedische patiënt.[9-11]
Profylaxestrategieën
Naast algemene maatregelen rondom de operatie zijn er ook antibiotische profylactische strategieën. Deze kunnen zowel lokaal als systemisch worden toegepast. Het materiaal dat ingebracht wordt, kan ook gemengd worden met antibiotica.
S. aureus-dekolonisatie
Stafylokokken zijn belangrijke verwekkers van vroege postoperatieve infecties. De prevalentie van S. aureus-neusdragerschap onder de Nederlandse bevolking wordt geschat op 25 tot 30 procent.[12] Dit komt overeen met de gevonden incidentie bij patiënten die een primaire plaatsing van een gewrichtsprothese ondergingen.[13] Er zijn geen studies bekend naar prevalentie onder patiënten die revisiechirurgie van een gewrichtsprothese ondergaan. Ondanks dat S. aureus-dragerschap een verhoogd risico geeft op infectie, worden er in verschillende studies geen significante reducties van POWI aangetoond na dekolonisatie met mupirocine. Bode et al. laten wel een significante reductie van diepe POWI zien wanneer gedekoloniseerd wordt met mupirocine gecombineerd met chloorhexidine.[14] Gezien de lage kosten van dekolonisatie is het meer kosteneffectief om universeel te dekoloniseren dan vooraf te screenen.[15] Het succes van de dekolonisatiestrategie op de dag van de operatie en een week daarna is 80 procent respectievelijk 68 procent.[16] Het risico op resistentie moet echter worden meegewogen. De incidentie van mupirocine-geïnduceerde resistentie wordt wisselend beschreven van 0 tot 30 procent. Hierbij wordt er niet tot nauwelijks resistentie gezien als gevolg van perioperatieve kortdurende dekolonisatie.[17,18] Het aantal onderzoeken hiernaar is echter beperkt. Hoewel dekolonisatie in veel centra wordt toegepast, is het in de verschillende richtlijnen niet opgenomen. In navolging van de IDSA-richtlijn en SWAB-richtlijn voor preventie van POWI is het advies om preoperatieve dekolonisatie in ieder geval bij bekend S. aureus-dragerschap toe te passen. Dit kan van toepassing zijn bij bijvoorbeeld een eerdere (wond)infectie veroorzaakt door een S. aureus of bewezen dragerschap.
Systemische antibiotische profylaxe
De SWAB-richtlijn adviseert cefazoline als eerste keus voor chirurgische antibiotische profylaxe. Dit is in lijn met de internationale richtlijnen en is gebaseerd op de meest voorkomende verwekkers van postoperatieve wondinfecties. Profylaxe met een alternatief middel zoals vancomycine of clindamycine laat een verhoogde kans op PJI zien ten opzichte van cefazoline, en moet daarom zoveel mogelijk vermeden worden.[19,20] Bij een beschreven allergie voor antibiotica is het daarom raadzaam om na te gaan of dit werkelijk om een allergische reactie gaat en niet enkel een bijwerking. Dit is vaak eenvoudig te achterhalen. De uiting, ernst en tijdstip van ontstaan van de allergische reactie bepalen of er daadwerkelijk een contra-indicatie is voor cefazoline. Desgewenst is beoordeling door internist of allergoloog geïndiceerd.[21]
Bij een contra-indicatie voor cefazoline kan vancomycine of clindamycine gebruikt worden als alternatief, zoals ook beschreven in de SWAB-richtlijn.
Naast het middel is ook de duur van de profylaxe veelbesproken. Gedurende de afgelopen decennia is de aanbeveling voor de duur steeds verder verkort naar het huidige CDC-2017-advies om géén antibiotische profylaxe te geven na het sluiten van de wond of hoogstens gedurende de eerste 24 uur postoperatief.[22] Goede onderbouwing vanuit de literatuur is schaars. Vele studies hebben een retrospectieve opzet, dan wel een gebrek aan power om de onderzoeksvraag te beantwoorden. De onderzochte populaties in verschillende studies zijn niet uitgesplitst in primaire plaatsingen of revisies en er worden uiteenlopende antibiotische regimes gebruikt. Naar aanleiding van de aangepaste richtlijn van de CDC in 2017 is er een systematische review en meta-analyse verricht naar de werkzaamheid van verlengde profylaxe. In de meta-analyse werden 51.627 patiënten uit 32 studies geanalyseerd, waarbij er geen voordeel werd gevonden van het continueren van de profylaxe na sluiten van de wond.[23] Aangezien de inclusie enkel primaire plaatsing betrof, zijn deze resultaten niet vanzelfsprekend te extrapoleren naar revisiechirurgie. Er zijn aanwijzingen dat een geselecteerde patiëntengroep voordeel zou kunnen hebben bij verlengde profylaxe, maar dit betreft retrospectief onderzoek van matige kwaliteit [24] Bij (een subpopulatie van) patiënten die revisiechirurgie ondergaan, en die een verhoogd risico hebben op postoperatieve infectie, zou er op theoretische gronden een plaats kunnen zijn voor verlengde profylaxe. Dit moet wel afgezet worden tegen de nadelen van mogelijk toename van resistentie en druist in tegen het huidig beleid van rationeel antibioticumgebruik. Een groot prospectief gerandomiseerde studie (REViSION) in Nijmegen (Radboudumc en Sint Maartenskliniek) is van start gegaan om de rol van verlengde profylaxe te onderzoeken bij patiënten die een aseptische revisie van hun gewrichtsprothese ondergaan.
Doseren
In het tijdperk van toenemende obesitas neemt de aandacht voor aangepaste dosering van medicatie toe. Zo ook de dosering van perioperatieve profylaxe. De International Consensus Meeting 2018 Philadelphia (ICM 2018) adviseert om de dosis cefazoline te verhogen bij patiënten met een BMI van meer dan 35 of een gewicht van meer dan 120 kg. De kwaliteit van de onderbouwing van deze aanbeveling is matig. De aanbeveling is gebaseerd op observaties in grote retrospectieve cohortstudies die een verhoogde incidentie van PJI laten zien in de groep patiënten met obesitas.
Daarnaast werd er een verlaagde cefazolineconcentratie in vet gezien bij patiënten die bariatrische chirurgie ondergingen. Bij deze populatie werd een verhoogde incidentie van postoperatieve wondinfectie gezien na de ingreep. Op basis van deze bevindingen wordt aangenomen dat de cefazoline-dosering verhoogd moet worden in geval van obesitas. De studies zijn echter niet bewijzend voor onderdosering van cefazoline als oorzaak voor de verhoogde incidentie van infectie. Een patiënt met morbide obesitas heeft wellicht andere factoren (matige conditie of zelfzorg, comorbiditeit, malnutritie, verminderde weefsel doorbloeding, mindere mobiliteit, et cetera) die de incidentie van infectie kunnen verhogen.[25] Blum et al. zijn in hun recente review kritisch op de aanbeveling om de dosis van cefazoline profylaxe te verhogen bij obesitas.[26] Verschillende studies naar de concentratie van cefazoline in bot bij verschillende gewichtsklassen laten namelijk geen verschil zien. Wel wordt een hogere botconcentratie van cefazoline in heup ten opzichte van knie gezien, ongeacht het gewicht van de patiënt. Sharareh et al. lieten in hun prospectieve studie zien dat de trabeculaire concentratie van cefazoline in bot niet afhankelijk is van het gewicht van de patiënt. Vancomycine-concentratie in bot was in de analyse wel geassocieerd met het gewicht van de patiënten, waarbij vancomycine een hoger verdelingsvolume heeft dan cefazoline. Dit zorgt voor hogere mate van vancomycine-depositie in weke delen, met een mindere beschikbaarheid voor depositie in bot.[27]
Cement en materiaal
Naast systemische antibiotica kan er met antibiotica in het cement ook een lokaal hoge spiegel bereikt worden. Deze lokale hoge spiegels geven nauwelijks systemische toxiciteit.[28] Antibiotica die veel gebruikt worden om in het cement te mengen zijn vancomycine, gentamicine, tobramycine en clindamycine. Dit zijn niet de enige middelen die lokaal toegepast kunnen worden, zo kunnen ook fosfomycine, colistine, daptomycine, linezolid, meropenem, ciprofloxacine en azolen worden gebruikt. Het toegepaste middel moet hittebestendig zijn, om de opwarming tot ongeveer 70 graden Celcius tijdens de bereiding van het cement te weerstaan. Bètalactam-antibiotica zijn niet hittebestendig en vallen snel uiteen, waardoor ze niet gebruikt kunnen worden in cement. Het middel moet zich niet te sterk binden met het cement, zodat het vrij kan komen uit het materiaal.
Wanneer er een te grote hoeveelheid antibiotisch poeder gebruikt moet worden om vrij te laten komen uit het materiaal, gaat dit ten koste van de stabiliteit van het cement. Het gebruik van antibioticumhoudend cement wordt ook geassocieerd met resistentie tegen de middelen. Het vrijkomen van antibiotica uit het cement neemt gedurende de tijd af. Door een langdurige blootstellen van bacteriën aan concentraties onder de MIC kan resistentie tegen het gebruikte antibioticum ontstaan.[28] Om deze reden is er gezocht naar een alternatieve manier van antibacteriële werking. Ionen die uit zilver vrijkomen vormen zogeheten reactive oxygen species (ROS), die de celwand van bacteriën beschadigen. Zilver kan gemengd worden in het cement of kan gebruikt worden als coating van de prothese. Afhankelijk van de grootte van de partikels is er werkzaamheid tegen bijvoorbeeld Staphylococcus spp. zonder dat het de stevigheid en stabiliteit van het cement en implantaat aantast.[29] Bioactieve glaskorrels worden gebruikt als vulmiddel op de plek van botverlies. Deze glaskorrels bevatten minder silica en hogere concentratie van calcium en fosfor dan normaal glas. De glaskorrels worden in de loop van de tijd geabsorbeerd, waardoor verwijdering niet nodig is. Door de samenstelling stimuleert het de botaanmaak. Door het oplossen van de glaskorrels treedt er een verhoging van de pH en osmotische druk op. Dit zorgt voor een antibacteriële werking.[30]
Toekomst
Een PJI is een belangrijke complicatie van het plaatsen van een gewrichtsprothese. Er zijn uiteenlopende preventieve maatregelen onderzocht en beschreven om deze complicatie te voorkomen. Hoe dan ook zullen we rekening moeten houden met een toenemend aantal patiënten met een gewrichtsprothese en een PJI als gevolg daarvan. De huidige en toekomstige patiënt die een gewrichtsprothese krijgt zal een oudere patiënt zijn met meerdere comorbiditeiten. Een belangrijke taak ligt in het naleven van de huidige preventieve protocollen, waarbij aandacht voor comorbiditeit en conditie van de patiënt, hygiënische omstandigheden rondom de operatie en operatietechnieken essentieel zijn om postoperatieve infecties te voorkomen. Ondanks de vele studies die gedaan zijn naar profylactische strategieën in het algemeen, ligt de toekomst wellicht in meer preventieve interventies op maat. Het verbeteren van de conditie van de patiënt, het al dan niet dekoloniseren en de optimale timing, dosering en duur van intraveneuze antibiotische profylaxe kunnen er onderdeel van uitmaken.