Samenvatting
Nu meervoudige antimicrobiële resistentie een bedreiging vormt voor de gezondheidszorg is bacteriofaagtherapie opnieuw onder de aandacht gekomen als mogelijk alternatief voor antimicrobiële therapie. Bacteriofagen worden gekarakteriseerd door een grote diversiteit, ze zijn in overvloed aanwezig, in staat zichzelf in grote hoeveelheden te multipliceren. Fagen zijn goede kandidaten om de strijd met bacteriële infecties aan te gaan. Maar faagtherapie gaat gepaard met nogal wat complicerende factoren, waarvan het optreden van bacteriële resistentie het meest in het oog springt. Resistentie vindt plaats in de verschillende stappen van de virusreplicatie. Anderzijds zijn fagen zelf in staat tot adaptatie en het te boven komen van resistentie.
Interacties tussen bacteriën en fagen, zoals de resistentiemechanismen van de bacterie tegen de faag, zullen moeten worden ontrafeld om succesvolle strategieën te ontwikkelen.
Abstract
In an age where multiple drug resistant bacteria pose a serious threat to world health, bacterio-phage therapy has arisen as a possible alternative to conventional antibiotics. A huge diversity and abundance, rapid killing kinetics and the possibility of self-replication are some of the characteristics that make bacteriophages good candidates for
treating bacterial infections. However, bacteriophage therapy faces numerous challenges, amongst which the emergence of resistance stands out. This phenomenon occurs frequently and can take place through different elements targeting all the steps of the viral infective cycle. On the other hand, bacteriophages are also able to adapt and overcome resistance. In any case, it is important to unravel the interactions between bacteria and bacteriophages, as well as the mechanisms underlying resistance to phages, in order to design successful strategies for bacteriophage therapy. In this review, the current knowledge about mechanisms of bacteriophage resistance is discussed, as well as the genetic basis that accounts for them, and ways in which bacteriophages counter-attack against these systems.
Feuilleton in vijf delen
In vijf delen (in achtereenvolgende uitgaven van het NTMM) worden de huidige kennis van bacteriofaagresistentie, de genetische oorzaak die daarvoor verantwoordelijk is en de manier waarop fagen de tegenaanval inzetten, besproken. Het eerste deel van in totaal vijf delen staat in deze editie van het tijdschrift. Hierin wordt een introductie in de faagbiologie gegeven en wordt de levenscyclus van de faag belicht.
Introductie
In de afgelopen jaren zijn bacteriofagen onder de aandacht gekomen als potentiële behandeling tegen multiresistente bacteriën. Maar het idee van gebruik van fagen als therapie tegen persisterende infecties bestaat al langer. Hoewel de bacteriofaag waarschijnlijk het meest talrijke organisme op aarde is, werd deze pas ontdekt het begin van de 20e eeuw. Frederick William Twort en Félix d'Herelle waren de eersten die onafhankelijk van elkaar bacteriofagen beschreven.[1,2] d’Hérelle onderkende daarbij ook de therapeutische potentie ervan. De “onzichtbare microben” die hij beschreef, waren geïsoleerd uit ontlasting van patiënten die waren hersteld van een Shigella dysenteriae-infectie.
De interesse in fagen als potentiële behandeling tegen bacteriële infecties verminderde na de ontdekking van penicilline 20 jaar later.[3] Desondanks won de therapeutische toepassing aan populariteit in de voormalige Sovjetrepubliek, met name in Georgië, waar fagen kort na hun ontdekking in de klinische praktijk werden toegepast voor het behandelen van geïnfecteerde wonden en gastro-intestinale infecties.[4] Het gebruik van fagen werd onderzocht in verschillende instituten, waaronder het Eliava Instituut in Tbilisi, Georgië. Faagcocktails behoren tot op heden tot de gebruikelijke behandeling in Georgië en andere voormalige Sovjetrepublieken en zijn daar te koop bij de apotheek. In westerse landen heeft dit geen navolging gevonden door de gebrekkige methodologie van de onderzoeken en de ontoegankelijkheid van de veelal Russische literatuur waarin gerapporteerd werd.[3]
De situatie rondom antibioticumresistentie in de westerse samenleving wordt steeds zorgelijker. In 2015 heeft de Wereld Gezondheid Organisatie (WHO) een actieplan in het leven geroepen om dit groeiende probleem aan te pakken, hetgeen heeft geleid tot hernieuwde interesse in faagtherapie.[5] Waarschijnlijk stamt de bekendste casus die recent is beschreven uit 2017, van Schooley et al. waarbij een multiresistente Acinetobacter baumanni-infectie succesvol is behandeld met een gepersonaliseerde bacteriofaagcocktail die van tevoren in vitro is getest tegen de Acinetobacter-isolaten van deze patiënt.[6]
Een andere toegepaste behandeling waarin fagen een bewezen effect hebben, is het gebruik van een fecesfiltraat bij de behandeling van recidiverende Clostridoides difficile-infecties. Deze toepassing is vergelijkbaar met fecestransplantatie, met het verschil dat de bereiding steriel gefiltreerd is waardoor alleen het bacteriële debris, eiwitten, antibacteriële en metabole bestanddelen, oligonucleotiden en virussen (c.q. fagen) worden toegediend. Ott en anderen beschrijven in 2017 hoe bij deze aanpak C. difficile wordt geëradiceerd voor een periode van ten minste zes maanden, hetgeen gepaard gaat met veranderingen in het intestinale microbioom en virioom van de patiënten.[7]
Al met al lijkt faagtherapie een veilige en veelbelovende techniek in de strijd tegen multiresistente bacteriën en de overtuiging dat er gezocht moet worden naar mogelijkheden voor implementatie neemt toe zowel in de wetenschappelijke wereld als daarbuiten.[8]
Er zijn desondanks nog diverse hindernissen te nemen voordat faagtherapie kan worden toegepast in westerse landen. Allereerst wordt het toepassen van faagtherapie bemoeilijkt door de regelgeving binnen de gezondheidszorg. Er wordt gewerkt aan de regelgeving om gebruik van faagtherapie via magistrale bereiding mogelijk te maken en te standaardiseren.[9]
Naast regelgeving komen er veiligheidsoverwegingen kijken bij het toedienen van fagen aan mensen. In casuïstiek zijn tot dusver geen ernstige bijwerkingen beschreven. Toch bestaan er zorgen dat bepaalde typen filamenteuze fagen aanleiding geven tot het vormen van biofilms.[10] Dit laatste zou echter geen probleem moeten zijn omdat filamenteuze fagen geen rol spelen in therapeutische toepassingen. Een ander obstakel is het mogelijk veroorzaken van dysbiose in bijvoorbeeld het maagdarmstelsel door het introduceren van exogene virussen. Dit treedt niet op indien de fagen gericht worden toegediend ter plaatse van de infectie, bijvoorbeeld topicaal. Overigens zijn bacteriofagen selectief in de bacteriën waarop ze aangrijpen, waardoor het onwaarschijnlijk is dat daarbij de commensale flora wordt aangetast.[11] Een andere zorg is het vrijkomen van endotoxinen door lysis van de bacteriën, zoals bij de toediening van antibiotica die aangrijpen op de celwand.[12]
De belangrijkste vraag blijft of faagtherapie effectief is in het behandelen van bacteriële infecties en zo ja, voor hoe lang. Bacteriën beschikken over meer mechanismen om bacteriofagen af te weren. In bacteriële populaties die geïncubeerd worden met fagen, worden direct of binnen enkele uren al mutanten gevonden die ongevoelig zijn voor de bacteriofagen waaraan ze blootgesteld worden. De kennis over interacties tussen fagen en bacteriën is flink gegroeid ten opzichte van de beginjaren van de faagtherapie.
De biologie van bacteriofagen
Grondige kennis van faagbiologie is van cruciaal belang voor de ontwikkeling van therapeutische toepassingen. Kennis over de verschillende virale eigenschappen en de mechanismen waarmee de gastheer geïnfecteerd wordt, is noodzakelijk om de bacteriële afweermechanismen te bestuderen. Met deze kennis kunnen technieken worden ontwikkeld voor het ontwijken of onderdrukken van deze bacteriële resistentiemechanismen, om de kans van slagen van faagtherapie te vergroten.
Fagen worden geclassificeerd op basis van morfologie of op basis van hun genoom. Er zijn drie verschillende groepen geïdentificeerd op basis van genoomtype en grootte. De eerste groep bestaat uit RNA-fagen, beschikkend over een klein enkelstrengsgenoom. De tweede groep bestaat uit fagen met een klein (meestal minder dan 10kb) enkelstrengs-DNA-genoom. Deze groep omvat fagen met een relatief groot DNA-genoom variërend van 30 tot meer dan 2000 kb, meestal dubbelstrengs. Fagen die potentieel geschikt zijn voor therapeutische toepassing behoren tot deze laatste groep, de orde van de Caudovirales.[13]
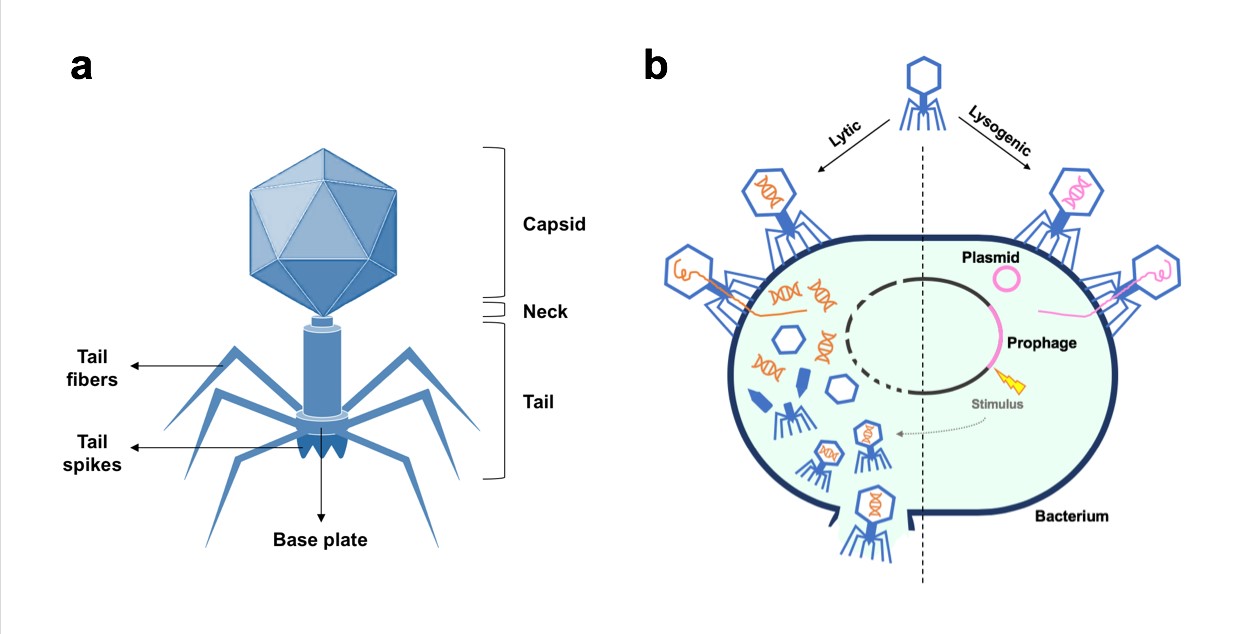
Caudovirales zijn fagen zonder envelop, bestaande uit een kop met een icosahedrale structuur en een staart (figuur 1a).[14]. De kop bestaat uit een eiwitstructuur met daarin een enkel molecuullineair, dubbelstrengs-DNA. De staart is een eiwitbuis bestaande uit een helix van opeengestapelde schijven met aan het distale uiteinde meestal spikes, een basis en tentakels (Eng: fibers). Sommige fagen hebben daarnaast een kraagachtige structuur tussen de kop en de staart. Voorheen vormden de morfologische verschillen van de staart de belangrijkste criteria voor het onderscheiden van verschillende virusfamilies binnen deze orde. Met behulp van genoombrede sequentieanalyse en fylogenetische analyse wordt tegenwoordig een grotere variëteit aan verschillen waargenomen tussen de soorten Caudovirales.[15] Zo worden nu binnen deze orde vier nieuwe families onderscheiden: Siphoviridae, Podoviridae, Myoviridae en Ackermannviridae. Siphoviridae worden gekarakteriseerd door hun lange, niet-contractiele staart. Podoviridae hebben korte niet-contractiele staarten, Myoviridae en Ackermannviridae hebben beide lange contractiele staarten maar verschillen op genomisch en proteomisch niveau.[16] De structuren aan het distale eind van de staart herkennen de receptoren aan de buitenkant van de bacterie waaraan de faag geabsorbeerd wordt.[14] Binding kan zowel reversibel als irreversibel zijn, met soms meerdere receptoren. Over het algemeen is de binding erg gastheerspecifiek. De verschillende receptoren en de moleculen die een rol spelen bij de aanhechting van fagen, worden uitgebreid beschreven in een review van Bertozzi Silva et al. uit 2016.[17]
Na de absorptie van het virion wordt het genetisch materiaal geïnjecteerd in het cytoplasma van de gastheer. Peptidoglycaan-hydrolases van het viruspartikel breken hiervoor de celwand af waarna het DNA met daarbij soms enkele eiwitten via de staart in de bacterie terecht komt. Bij sommige bacteriofagen vindt dit proces stapsgewijs plaats waarbij transcriptie van een als eerste geïnjecteerd deel van het DNA nodig is voordat de rest van het DNA kan worden opgenomen door de bacterie.
Er wordt onderscheid gemaakt tussen virulente en gematigde (Eng: temperate) fagen. De virulente faag kent alleen een lytische cyclus, de gematigde fagen zowel een lytische als een lysogene cyclus, dan wel alleen een lysogene (figuur 1b). Bij de lytische cyclus worden de cellulaire processen van de gastheer overgenomen door de faag waarbij de virale genen tot expressie komen in plaats van de genen van de gastheer. Sommige fagen gebruiken hiervoor het bacteriële RNA-polymerase, andere bevatten hun eigen transcriptie-enzym. Later komen de genen die coderen voor kapseleiwitten en eiwitten die nodig zijn voor lysis van de gastheercel tot expressie. Het gehele proces leidt tot de productie van diverse viruspartikels die vrijkomen bij lysis.[18]
Bij de lysogene cyclus wordt het faag-DNA ingebouwd in het bacteriële DNA als profaag-DNA. Op bepaalde momenten, zoals onder stressomstandigheden, kan het tot expressie komen. Naast de lytische cyclus kunnen gematigde fagen tevens een lysogene cyclus doorlopen (figuur 1b). In dat geval blijft het virale genoom aanwezig in de gastheer als plasmide of neemt het plaats in het bacteriële chromosoom als profaag. De infectiecyclus die een virion doorloopt, wordt bepaald door bacteriële repressorgenen die deel uitmaken van een quorum-sensingsysteem, of door communicatie tussen viruspartikels op basis van eiwitten.[19,20] De dichtheid van de bacteriepopulatie en de faagpopulatie lijkt hierin een doorslaggevende rol te spelen. Hoewel fagen die een lysogene cyclus kunnen doorlopen niet geschikt zijn voor faagtherapie, zijn zij cruciaal voor het ontwikkelen van resistentiemechanismen.
In de volgende delen van deze serie zullen we ingaan op de verschillende mechanismen waarmee bacteriën zich kunnen weren tegen bacteriofagen.