Samenvatting
Influenzavaccins bevatten traditioneel antigenen van drie influenzavirusstammen, A(H3N2), A(H1N1) en een type B-influenzavirus; trivalent vaccin (TIV). Eind jaren 70, begin jaren 80 van de vorige eeuw is influenzavirustype B geëvolueerd in twee genetische lijnen, B/Victoria/2/87 (B/Victoria) en B/Yamagata/16/88 (B/Yamagata), waarvan de hemagglutinines na verloop van tijd door verdergaande accumulatie van aminozuursubstituties steeds meer antigeen van elkaar zijn gaan verschillen. Hierdoor werden afnemend goed kruisreagerende antistoffen geïnduceerd door de B-lijn in het TIV-vaccin tegen virussen van de andere B-lijn. Dit resulteerde in 2012 in de aanbeveling van de Wereldgezondheidsorganisatie (WHO) voor de samenstelling van quadrivalent vaccin (QIV) waarin beide B-lijnen zijn opgenomen. Tot 2018/2019 werd in het Nederlandse Nationaal Programma Grieppreventie (NPG) TIV gebruikt, vanwege veronderstelde adequate kruisbescherming en bewezen kosteneffectiviteit. De ernstige door B/Yamagata gedomineerde epidemie van 2017/2018 was aanleiding voor de staatssecretaris om te besluiten met ingang van het 2019/2020 seizoen QIV in het NPG te gaan gebruiken. Dit artikel geeft een samenvattend overzicht van de wetenschappelijke achtergrond die tot dit besluit heeft geleid.
Abstract
Influenza vaccines traditionally contain antigens from three influenza virus strains, A(H3N2), A(H1N1) and a type B influenza virus; trivalent vaccine (TIV). In the late seventies/early eighties of the last century, type B influenza virus evolved into two genetic lineages, B/Victoria/2/87 (B/Victoria) and B/Yamagata/16/88 (B/Yamagata), of which the hemagglutinins became increasingly antigenically distinct over time. As a result, antibodies induced by the one B-lineage in TIV were increasingly less cross-reactive against viruses from the other B-lineage. In 2012, this resulted in recommendations by the World Health Organization (WHO) for the composition of quadrivalent vaccine (QIV) in which both B lineages are included. Until 2018/2019, TIV was used in the Dutch National Influenza Prevention Program (NPG) for assumed cross protection and proven cost-effectiveness. The severe 2017/2018 epidemic dominated by B/Yamagata prompted the State Secretary to decide to use QIV in the NPG starting in the 2019/2020 season. This article provides a summary overview of the scientific background that led to this decision.
Inleiding
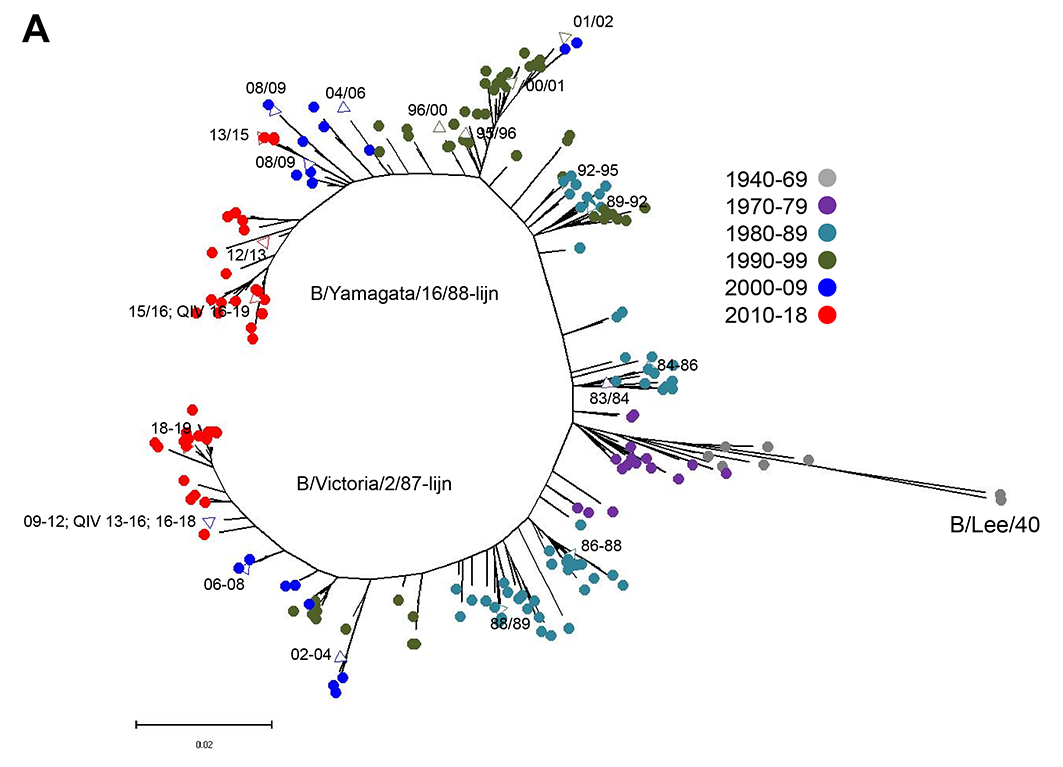
In Nederland is het influenzavaccin een geïnactiveerd trivalent vaccin (TIV), bestaande uit twee type A-stammen, A(H3N2) en A(H1N1), en één type B-stam. Sinds de influenzatype B-virussen zich eind jaren 70/begin jaren 80 van de vorige eeuw splitsten in twee fylogenetische lijnen (figuur 1A) is de B-stam in het vaccin een B-stam van de B/Victoria/2/87 (B/Victoria) lijn of de B/Yamagata/16/88 (B/Yamagata) lijn (figuur 2). De keuze voor een bepaalde B-stam was tot een aantal jaren geleden gebaseerd op de observatie dat 1) beide stammen in de regel niet gelijktijdig in één seizoen circuleren, 2) door vaccinatie opgewekte antistoffen tegen beide lijnen kruisreageren, en 3) de meeste epidemieën door A-stammen worden gedomineerd. De wereldwijd toenemende dominantie van B/Victoria of B/Yamagata in verschillende landen tijdens één seizoen sinds het begin van de 21e eeuw, de daardoor moeilijke voorspelbaarheid welke lijn komend seizoen dominant zou worden en de toenemende antigene afstand tussen beide lijnen (figuur 1B) leidden tot de ontwikkeling van quadrivalente vaccins (QIV). QIV bevatten naast een influenza A(H3N2)- en een influenza A(H1N1)pdm09-virus, de twee lijnen influenza B-virus. De Wereldgezondheidsorganisatie (WHO) geeft al sinds 2012 aanbevelingen voor de samenstelling van TIV en QIV, maar spreekt geen voorkeur uit voor het gebruik van een van beiden. Vaccinatie met QIV is al een aantal jaren geïmplementeerd in ons omringende landen (onder meer het Verenigd Koninkrijk, Duitsland en België). Dit artikel geeft een overzicht van de wetenschappelijke achtergrond van het besluit het QIV ook in Nederland te introduceren.
Epidemiologie van influenza B-virussen
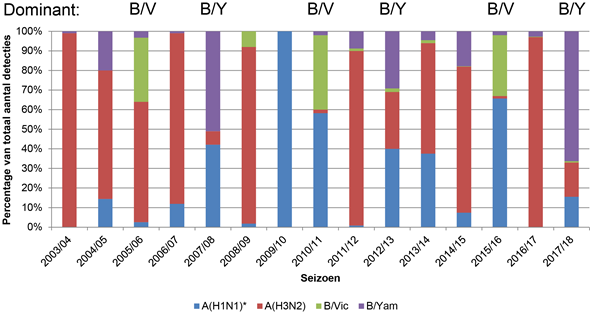
Het percentage influenzavirussen van type B varieert over de seizoenen. Van alle gedetecteerde influenzavirussen gedurende 15 influenzaseizoenen in Nederland (2003/2004–2017/2018) behoorde mediaan 18 procent (reeks van 0 tot 67 procent) tot type B-influenzavirussen (figuur 3). In twee seizoenen waren type A- en B-influenzavirussen co-dominant (2007/2008 en 2010/2011) en in één seizoen was type B het dominante circulerende influenzavirus (2017/2018). Er lijkt een cyclus te zijn van om de zes jaar toegenomen circulatie van B/Victoria-lijn of B/Yamagata-lijn terwijl B/Yamagata-lijn steeds twee jaar na B/Victoria toegenomen circuleert. Dit patroon is mogelijk te verklaren door de gedeeltelijke kruisbescherming door geactiveerd geheugen, de afnemende immuniteit in de populatie tegen beide lijnen na substantiële circulatie en de toegenomen antigene afstand tussen beide lijnen.
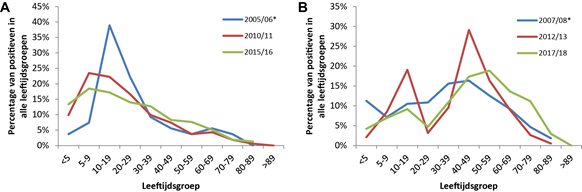
De leeftijd van patiënten die de huisarts consulteren met een B/Victoria-lijn of een B/Yamagata-lijn influenzavirusinfectie heeft een verschillende verdeling (figuur 4). B/Victoria-lijn influenzavirusinfecties worden vooral bij kinderen en jong volwassenen (0 tot 39 jaar) gevonden en B/Yamagata-lijn influenzavirusinfecties vooral bij de midden en oudere leeftijdsgroep (30 tot 79 jaar) en in mindere mate ook bij kinderen (0 tot 19 jaar). De leeftijdscurve in de B/Yamagata-lijn vertoont een opvallende dip met lage prevalentie bij de leeftijdsgroep 20 tot 29 jaar in de seizoenen 2012/2013 en 2017/2018. Dit werd mogelijk veroorzaakt door blootstelling van personen in deze groep aan B/Yamagata-lijnvirussen in hun eerste levensjaren in de 90-er jaren van de vorige eeuw, waardoor deze groep relatief beter beschermd was tegen een B/Yamagata- dan tegen een B/Victoria-infectie.
Influenzavirusvaccins en mismatches
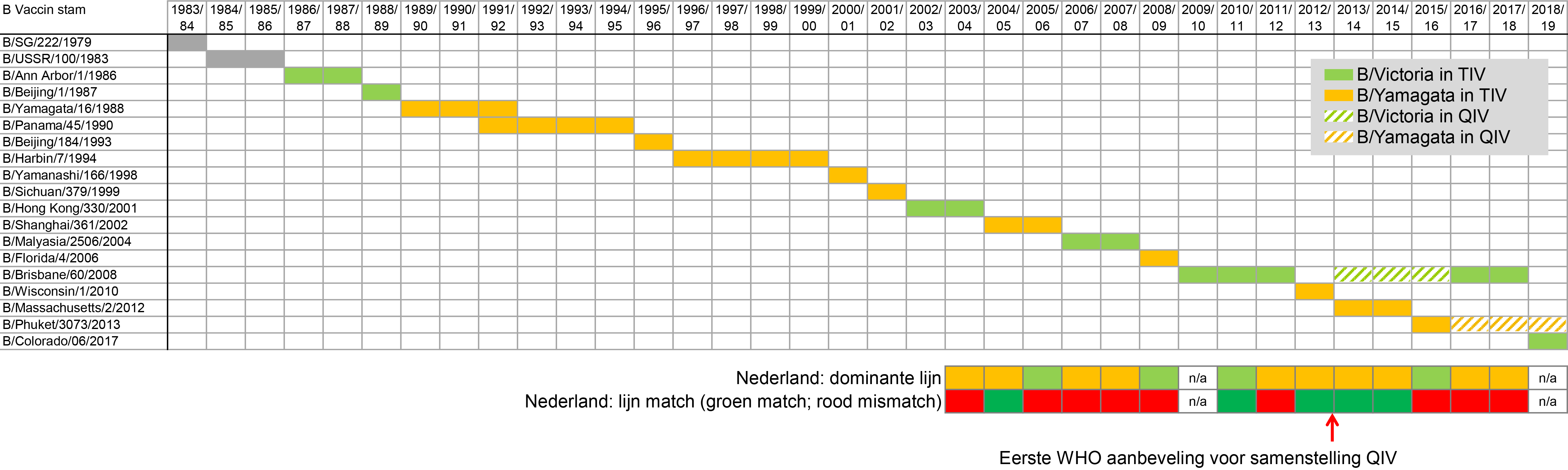
Voor type B-influenzavirussen geldt dat als er een andere B-lijn circuleert dan opgenomen in het seizoensvaccin, we spreken van een lijnmismatch. Dit resulteert tegelijkertijd ook in een antigeen verschil tussen het circulerende influenza B-virus en de vaccinstam, maar we spreken van lijnmismatch en niet van antigene mismatch om het te onderscheiden van de ‘echte’ antigene mismatch. We spreken van antigene mismatch als het A-subtype of de B-lijn van het circulerende influenzavirus wel is opgenomen in het vaccin maar het circulerende influenzavirus zodanig antigeen verschilt van het influenzavirus in het vaccin, dat hiermee bescherming nadelig beïnvloed wordt.2 Deze antigene mismatch ontstaat door aminozuursubstituties in het hemagglutinine, waartegen neutraliserende antistoffen zijn gericht. Zulke aminozuursubstituties kunnen ontstaan doordat de vaccinstam een half jaar voor uitlevering van het vaccin gekozen moet worden terwijl het influenzavirus in dat half jaar of tijdens het influenzaseizoen doorgaand evolueert. Antigene mismatch komt vooral voor bij type A-influenzavirussen en vooral bij A(H3N2). Maar deze antigene mismatch kan ook voorkomen bij type B-influenzavirussen en is reden voor een aanpassing van de B-stam in het vaccin bij gelijkblijvende lijn in het TIV (figuur 2). Over de periode van 15 seizoenen (2003/2004 tot 2017/2018) is er negen keer een lijnmismatch geweest tussen type B-influenzavirus in het vaccin en het circulerende type B-influenzavirus in Nederland (figuur 2). In diezelfde periode heeft evolutie het noodzakelijk gemaakt om vanwege antigene mismatch de vaccinstam voor B/Victoria drie keer aan te passen en voor B/Yamagata vier keer (figuur 2). Beide soorten mismatch hadden in meer of mindere mate een negatieve invloed op de vaccineffectiviteit.3,4
De influenza-epidemie van 2017/2018
De influenza-epidemie van 2017/2018 werd in Nederland gekenmerkt door ernstige en gecompliceerd verlopende infecties door B/Yamagata-influenzavirus met een grote (over)belasting van de zorg, hoge morbiditeit en mortaliteit.5 De veronderstelling dat ernstige influenza-epidemieën veroorzaakt worden door type A-influenzavirussen, en infectie met type B-influenzavirussen over het algemeen tot minder ernstige ziekte leidt, werd hiermee weerlegd. Een vergelijkbare ziekte-ernst voor infecties met influenza A- en B-virussen is eerder al in de literatuur beschreven.6 Ook het gebruikelijke patroon van type A-dominantie gevolgd door type B-circulatie aan het einde van een seizoen werd in de winter van 2017/2018 tijdens een lange, 18 weken durende, griepepidemie doorbroken.5 De epidemie werd vanaf het begin door type B/Yamagata-lijn gedomineerd, met middelmatige circulatie van zowel A(H1N1)pdm09 als A(H3N2) aan het einde van het seizoen. Het TIV voor het seizoen 2017/2018 bevatte de B/Victoria-lijn. Naast deze lijnmismatch van type B-influenzavirus was er tijdens het seizoen 2017/2018 een antigene mismatch voor de A(H3N2)-influenzavirussen.5
Ontwikkelingen naar gebruik van quadrivalent vaccin
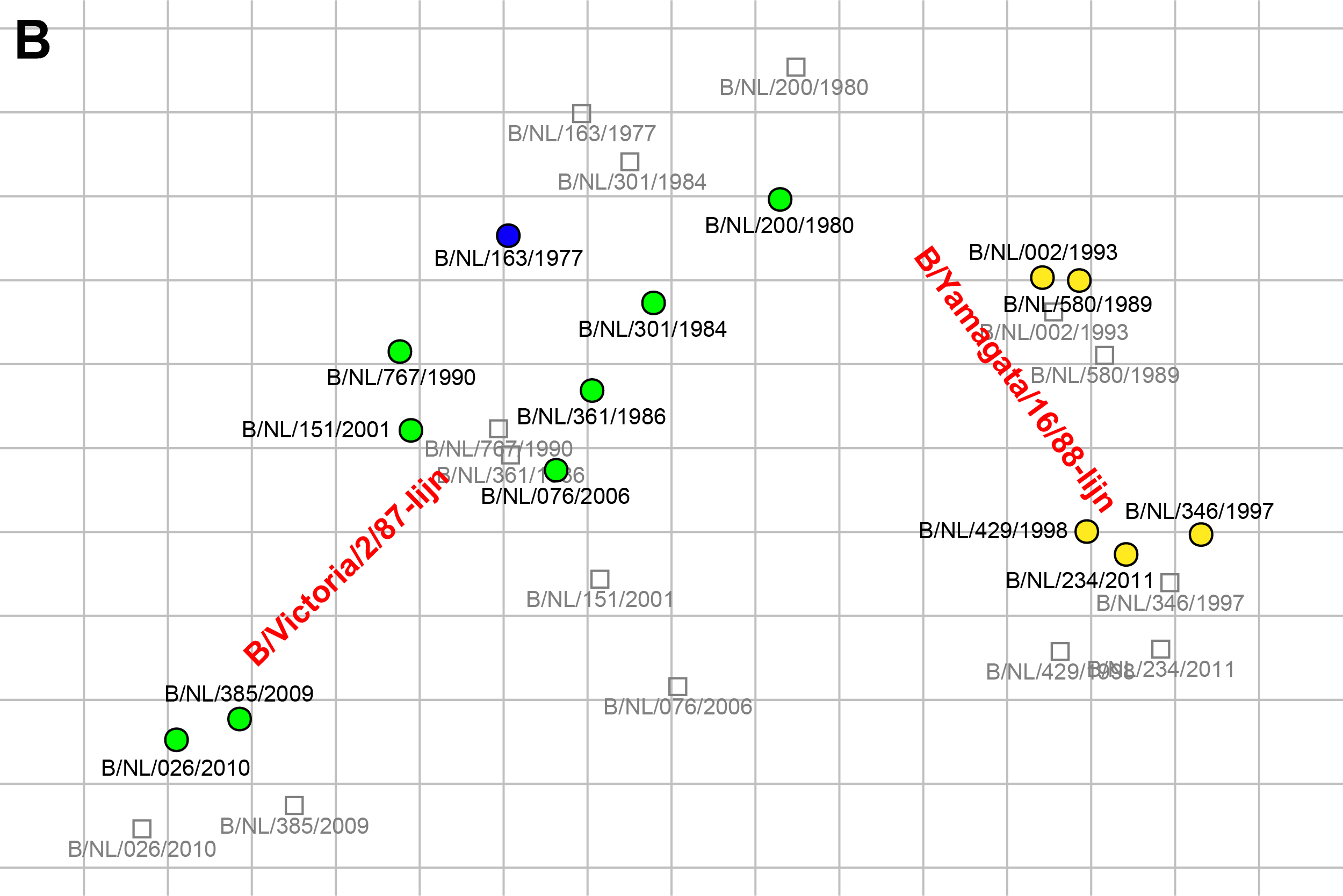
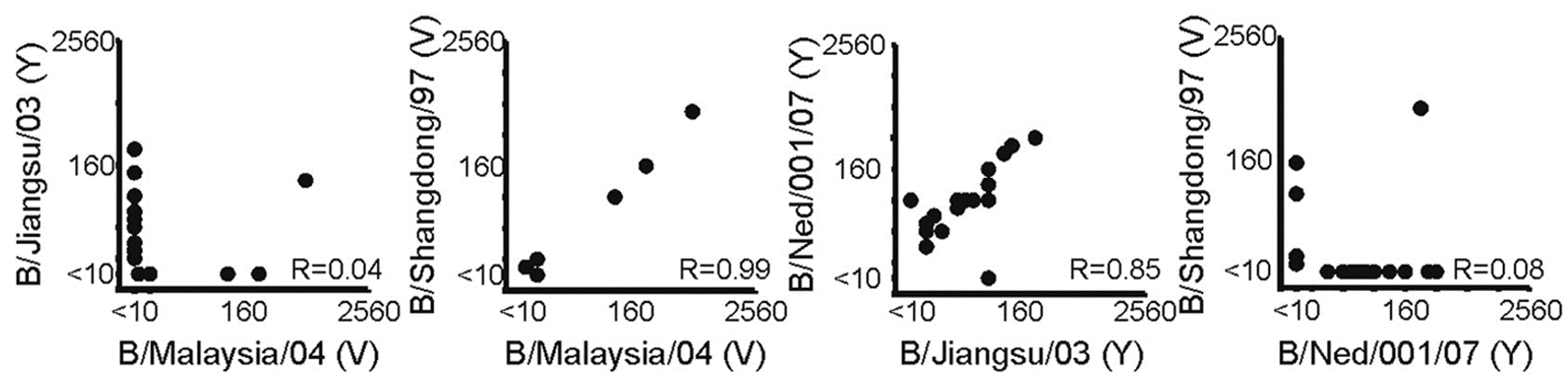
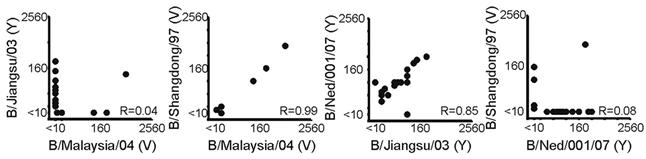
Door de jaren heen is er dus sprake van grote fluctuaties in het circuleren van de twee lijnen influenza B-virus en blijkt het niet goed mogelijk om te voorspellen welke B‐lijn het volgende seizoen zal circuleren. Toen de twee lijnen influenza B-virus ontstonden (figuur 1) leverde vaccineren met een van beide lijnen nog voldoende kruisbescherming op tegen de andere lijn.1 Als gevolg van de doorgaande evolutie van beide lijnen leverde een doorgemaakte natuurlijke infectie met influenza B-virus van een van beide B-lijnen bij kinderen op vierjarige leeftijd in de periode 2006/2007 geen kruisbeschermende antistoffen meer op, zoals geïllustreerd in een dwarsdoorsnede serologische studie in Nederland (figuur 5).7 Beschermende antistoffen tegen een van beide B-lijnen waren wel breed reactief tegen influenza B-virussen van dezelfde lijn maar afkomstig uit verschillende jaren (figuur 5). Deze verminderde kruisreactiviteit tussen beide lijnen wordt ook gezien bij vaccinatie met TIV.8 De groter wordende antigene verschillen door evolutie van beide lijnen en de daardoor veroorzaakte verminderde kruisreactiviteit tussen de lijnen bij vaccinatie heeft de WHO in 2012 doen besluiten dat de kruisreactiviteit geïnduceerd door TIV onvoldoende was.8 Sindsdien doet de WHO ook aanbevelingen voor de samenstelling van QIV. In Noord‐Amerika, Australië en Europa wordt sinds 2013/2014 in toenemende mate gevaccineerd met QIV. In Nederland werd tot en met het seizoen 2018/2019 gebruikgemaakt van TIV. Na de B/Yamagata-epidemie van 2017/2018 heeft het RIVM begin september 2018 een Outbreak Management Team bijeengeroepen voor het opstellen van een advies voor vaccinaties en surveillance van complicaties van griep.9 Dit wetenschappelijke advies is voorgelegd aan het zogeheten Bestuurlijk afstemmingsoverleg, waarin het wetenschappelijk advies werd vertaald naar een beleidsadvies.10 De staatssecretaris heeft vervolgens de Tweede Kamer geïnformeerd over de maatregelen die hij op basis van beide adviezen heeft genomen.11 Een van die maatregelen was dat voor het influenzaseizoen 2019/2020 QIV´s de TIV´s in het Nederlandse Nationaal Programma Grieppreventie (NPG) zullen vervangen. De TIV´s die voor 2018/2019 in het NPG gebruikt werden, zijn het ‘subunit’ vaccin Influvac van producent Abbott en het ‘split virion’ (gesplitst virus) vaccin Vaxigrip van producent Sanofi Pasteur. Beide typen vaccins bevatten geen levend virus. Voor 2019/2020 zullen de quadrivalente varianten van deze vaccins in het NPG worden opgenomen.
De effectiviteit van QIV
Gerandomiseerde klinische trials hebben aangetoond dat voor alle leeftijdsgroepen de immuunrespons na vaccinatie met QIV vergelijkbaar is met die na vaccinatie met TIV.12,13 Een systematische review van immuunresponsstudies concludeerde dat vooral voor kinderen de extra immuniteit voor het griepseizoen tegen de tweede B-lijn van belang is.14 Omdat de meeste ouderen tijdens hun leven regelmatig zijn blootgesteld aan circulerende type B-virussen en dus een zekere mate van immuniteit hebben opgebouwd, is de impact van een B-lijnmismatch bij ouderen minder dan bij kinderen.14 De immuunrespons kan echter niet direct vertaald worden naar een effectiviteit van het vaccinatieprogramma. Diverse factoren zijn van belang voor de effectiviteit van het vaccinatieprogramma, waaronder vaccinatiegraad, match tussen vaccinstam en circulerende stam en doorgemaakte infecties met influenzavirus en griepvaccinaties in het verleden. De vaccineffectiviteit (VE) is hoger naarmate er een betere antigene overeenkomst of ‘match’ is tussen de vaccinvirussen en de circulerende virussen.4 Ook bij een ‘mismatch’ kan er echter sprake zijn van enige bescherming door inductie van kruisreagerende antistoffen. Hoewel de Yamagata-lijn van influenzavirustype B niet in het vaccin van het door B/Yamagata gedomineerde seizoen 2017/2018 zat, gaf het TIV met daarin een influenza B-virus van de Victoria-lijn in Nederland toch een redelijke bescherming met een VE van 44 procent (95% betrouwbaarheidsinterval: 11 tot 65%).5 Een garantie dat een TIV- of QIV-vaccin dat in het voorjaar wordt ontwikkeld voor alle drie of vier virussen in het vaccin een goede match zal zijn met de virussen die een half jaar later gaan circuleren is er nooit.2 Ook als de ‘juiste’ B‐lijn in het vaccin is opgenomen, betekent dit niet dat het vaccin ook altijd voldoende gelijkenis (antigene match) heeft met het epidemische B-virus. Zo zijn in 2017 twee nieuwe varianten van de B/Victoria-lijn opgedoken met twee of drie aminozuurdeleties in het hemagglutinine (respectievelijk B/Colorado/06/2017-like en B/Hong Kong/269/2017-like virussen) waardoor deze virussen een andere antigene samenstelling hebben dan de virussen zonder deze deleties. Deleties op precies deze plek stonden aan de basis van de splitsing in de B/Victoria- en B/Yamagata-lijnen. Voor 2018/2019 rapporteerde de WHO dat er weinig circulatie van influenza B-virussen was, maar dat er een mix van de drie B/Victoria-lijnvarianten, de ene zonder deleties en de twee met deleties, rondging.15 Ondanks de antigene verschillen tussen deze varianten geven humane serologiestudies aan dat na vaccinatie met de huidige B/Victoria-vaccinstam met twee deleties (B/Colorado/06/2017-like virus) er redelijk tot goede reactiviteit is van opgewekte antistoffen met alle drie de varianten.15
Gebruik van TIV in Nederland is bewezen kosteneffectief.16 Voor de kosteneffectiviteit van gebruik van QIV in vergelijking met TIV zijn vooral de hogere kosten van QIV (een extra stam in het vaccin), de mate waarin influenza B-virussen circuleren en de ernst van influenza B-virusinfecties van belang.9 Op basis van wetenschappelijke aannames en geschatte aankoopprijs van QIV is duidelijk dat het vaccinatieprogramma duurder zal worden, maar vooralsnog lijkt het binnen de geaccepteerde criteria voor kosteneffectiviteit te blijven.9
Vaccinsamenstelling voor het seizoen 2019/2020
Jaarlijks wordt in februari de vaccinsamenstelling voor het noordelijk halfrond bepaald door de WHO.2 Voor het seizoen 2019/2020 heeft de WHO geadviseerd om in TIV wederom een influenza B-virus van de Victoria lijn te gebruiken.15 Het gaat om de nieuwe variant van B/Victoria met twee aminozuurdeleties in het hemagglutinine (B/Colorado/06/2017-like), die tijdens het seizoen 2017/2018 in beperkte mate circuleerde maar die wereldwijd toeneemt in proportie onder de type B-influenzavirussen. Daarom werd dit vaccinvirus ook al aanbevolen voor het noordelijk halfrond TIV voor 2018/2019.17 De verwachting is dat deze B/Victoria-vaccinstam slechts in geringe mate kruisreagerende antistoffen tegen B/Yamagata-lijnvirussen zal induceren, maar mogelijk wel B/Yamagata-geheugen kan activeren bij mensen die in de negentigerjaren van de vorige eeuw als eerste met Yamagata-lijnvirussen geïnfecteerd zijn geweest. Voor QIV is de B/Yamagata-stam aanbevolen die al sinds 2016/2017 in QIV wordt opgenomen: B/Phuket/3073/2013-like virus.15 De A(H1N1)pdm09-stam in het vaccin is gewijzigd in A/Brisbane/02/2018 (H1N1)pdm09-like virus omdat in humane serologiestudies onder gevaccineerden met de oude stam (A/Michigan/45/2015 A(H1N1)pdm09-like virus) een verminderde respons tegen het huidig circulerende A(H1N1)pdm09 werd gevonden.15 Omdat ten tijde van het vaststellen van de samenstelling van het vaccin in februari 2019 er observaties waren van recente genetische en antigene diversificatie van A(H3N2)-virussen die ook nog verschillen voor diverse regio’s in de wereld, is in een extra vergadering eind maart de samenstelling voor A(H3N2) aangepast.15,18 De WHO heeft gekozen voor een van de opkomende circulerende clades, clade 3C.3a A/Kansas/14/2017 (H3N2)-like virus, die vooral dominant was in Amerika. In Europa en Nederland circuleerden vooral nieuwe varianten van clade 3C.2a1b A(H3N2)-virussen.18 Antistoffen opgewekt tegen het clade 3C.3a vaccinvirus reageren slecht met recente clade 3C.2a1b-virussen.18 Het is voor de effectiviteit van de H3-vaccincomponent dus afwachten welke clade A(H3N2)-virus in het seizoen 2019/2020 gaat circuleren.
Het ECDC schrijft in haar ‘Risk assessment for seasonal influenza, EU/EEA, 2017–2018’: “As this is the fourth consecutive year in which the B virus included in the trivalent vaccine has not matched the circulating B viruses, EU/EEA Member States might consider increasing the availability and use of the quadrivalent influenza vaccine in their countries for the next season”.19 Dit zal ook het Nederlandse beleid zijn voor 2019/2020. De evolutie van de influenzavirustype B-lijnen over de laatste decennia - die in het seizoen 2017/2018 leidde tot een langdurige en hevige B/Yamagata-lijn gedomineerde epidemie ondanks een vaccineffectiviteit van 44 procent tegen B/Yamagata bij B/Victoria in het vaccin - heeft duidelijk gemaakt dat influenzavaccins met beide B-lijnen in het vaccin waarschijnlijk noodzakelijk zullen zijn voor een hogere vaccineffectiviteit tegen beide B-lijnen.