Samenvatting
Wereldwijd gezien is een HPV-gerelateerde aandoening de meest voorkomende soa. Verschillende typen HPV kunnen intra-epitheliale afwijkingen geven die kunnen leiden tot een cervixcarcinoom en kanker van de anus, penis of vulva. HPV-type 16 en 18 zijn de meest voorkomende verwekkers van cervixcarcinomen (70 procent).
Sinds 2006 zijn er verschillende HPV-vaccins beschikbaar, die empirisch bewezen veilig en effectief zijn tegen voorstadia van het cervixcarcinoom. In Nederland is een bivalent vaccin (bevat HPV-type 16 en 18) sinds 2009 opgenomen in het Rijksvaccinatieprogramma. Hoewel de introductie van dit vaccin gepaard ging met veel voorlichting, daalde de opkomst al snel vanwege onrust in de media over bijwerkingen en effectiviteit van het vaccin. In 2018 was de opkomst slechts 45,5 procent. De verschillen tussen een aantal Europese buurlanden in vaccinatiegraad voor HPV zijn groot.
Na 10 jaar ligt er nu een aanvraag bij de Gezondheidsraad om het HPV-vaccinatieprogramma te herzien. Het type vaccin (bi-, quadri- of nonavalent), de doelgroep en diens leeftijd worden opnieuw beoordeeld. In enkele andere landen om ons heen wordt de vaccinatie sinds kort ook aan jongens aangeboden. De reden hiervoor is tweeledig. Vaccinatie beschermt jongens tegen anus- en peniskanker. Daarnaast biedt het tevens vaccineren van jongens de mogelijkheid van groepsimmuniteit.
Summary
Worldwide, HPV-related disorders are the most common sexually transmitted infections. Several types of HPV cause intraepithelial neoplasia, which can develop into cervical cancer, vulvar cancer, anal and penile cancer. HPV-type 16 and 18 are most found as cause of cervical cancer (70 percent).
Various HPV vaccines have been available since 2006, which are empirically proven to be safe and effective against precursors of cervical carcinoma. In the Netherlands, a bivalent vaccine (containing HPV-types 16 and 18) has been included in the National Immunisation Programme (NIP) since 2009. Although the introduction was accompanied by a lot of public information, the turnout quickly declined due to negative publicity. There were negative rumors about side effects and the vaccine effectivity. The immunisation coverage in 2018 was just 45.5 percent. The immunisation coverage for HPV differs with our neighbouring countries.
Ten years later, there’s an application to the Health Council to revise the HPV vaccination programme. The type of vaccine (bi-, quadri- or nonavalent), the target group and its age will be reassessed. In other countries vaccination has recently also been offered to boys. Firstly because vaccination protects boys against anus and penile cancer. Also, the vaccination of both sexes improves herd immunity.
Inleiding
Tien jaar geleden werd de HPV-vaccinatie ingevoerd in het Rijksvaccinatieprogramma (RVP). We blikken terug op deze vaccinatie tegen baarmoederhalskanker, die sinds de invoering ervan regelmatig onderwerp van gesprek is geweest tussen voor- en tegenstanders.
HPV: Hoe zat het ook alweer?
HPV staat voor humaan papillomavirus, een DNA-virus behorend tot de familie Papillomaviridae. Bijna tweehonderd typen HPV zijn beschreven, die onderling verschillen in celtropisme, levenscyclus, klinische symptomen en oncogeniciteit.
De typen HPV worden op basis van DNA ingedeeld in genera. Met name het alfagenus kan de mucosa infecteren en ziekte veroorzaken bij mensen. Het bètagenus doet dit alleen bij immuungecompromitteerden. Andere genera zoals mu, nu en gamma, maar ook enkele laag-risicotypen van het alfagenus, veroorzaken goedaardige wratten, bijvoorbeeld bij de genitalia.1,2,3
De papillomavirussen van het alfagenus uit de hoog-risicogroep zijn het meest risicovol. Deze veroorzaken intra-epitheliale afwijkingen in het genitale gebied, die kunnen uitmonden in kanker van de vulva, cervix, anus of penis. HPV-16 is het meest voorkomende type en geeft tevens het hoogste risico op kanker.4
Cervixcarcinoom
De cervix uteri is het buisvormig deel van de uterus dat uitmondt in de vagina en is normaal gesproken 2 tot 3 cm lang. Ze bestaat uit de ectocervix (zichtbaar vanuit de vagina), bekleed met meerlagig plaveiselcelepitheel en de endocervix, bekleed met eenlagig cylinderepitheel. De grens tussen deze delen wordt de squamocolumnaire junctie (SCJ) genoemd. Onder invloed van hormonen en leeftijd verschuift de plaats van deze SCJ op de cervix, doordat cylinderepitheel wordt vervangen door metaplastisch plaveiselcelepitheel. Dit gebied wordt de transitiezone (TZ) genoemd.5 Volgens de huidige inzichten is de transitiezone de plaats waar de basaalcellen het meest kwetsbaar zijn voor veranderingen en waar abnormale celgroei kan ontstaan. Licht beschadigde basaalcellen kunnen geïnfecteerd raken met HPV, waarna ze zich differentiëren en er virale replicatie plaatsvindt.7 Bij het gebruikelijke loslaten van het afgeplatte epitheel komen de nakomelingvirionen vrij: er is dan sprake van een productieve infectie.8 Meestal verlopen deze infecties subklinisch, maar bij circa 20 procent ontstaan er CIN-laesies (cervicale intra-epitheliale neoplasie). Een aanzienlijk deel van de infecties wordt binnen een jaar geklaard door het lichaam.9 Bij een persisterende infectie die samengaat met bepaalde genetische veranderingen, kunnen de laesies echter uitmonden in hooggradige CIN-laesies en daarna in een cervixcarcinoom (voornamelijk plaveiselcel- of adenocarcinoom). Dit gebeurt bij 2 tot 5 procent van de vrouwen die een hoog-risicotype HVP-infectie oplopen. Meestal gaat het om HPV-16 en HPV-18: 70 procent van de cervixcarcinomen wordt hierdoor veroorzaakt. Nog eens 20 procent wordt veroorzaakt door HPV-31, HPV-33, HPV-45, HPV-52 of HPV-58.
Besmetting met HPV vindt plaats door direct epitheelcontact. De basale cellagen moeten bereikt worden; microlaesies in het epitheel door bijvoorbeeld seksueel contact zijn dus nodig. De berekende transmissiekans bij eenmalig seksueel contact is 60 procent. De transmissiekans van vrouw naar man is zelfs groter dan van man naar vrouw. Transmissiekans via niet-seksueel contact is gering.9,10 Wereldwijd gezien is een HPV-gerelateerde aandoening de meest voorkomende soa.
Het HPV-vaccin
Al decennialang wordt in Nederland bevolkingsonderzoek gedaan naar cervixcarcinoom, door middel van een uitstrijkje bij vrouwen van 30 tot 60 jaar (secundaire preventie). Sinds 2006 is het ook mogelijk om een HPV-infectie te voorkomen door te vaccineren (primaire preventie). Een van de voordelen hiervan is dat dit ook het adenocarcinoom (ongeveer 18 procent van de cervixcarcinomen) kan voorkomen, een carcinoom dat met de huidige uitstrijkjes niet goed vroegtijdig is op te sporen.11
Aan de basis van de huidige vaccins ligt de ontdekking dat bij de productie van het structurele L1-eiwit van HPV met behulp van recombinant-DNA-technologie, dit eiwit zich automatisch vouwt tot een virusachtig deeltje, een virus-like particle (VLP). Het lichaam maakt tegen deze VLP’s neutraliserende IgG-antistoffen aan en activeert het immunologisch geheugen.9,12 De vaccins werden ontwikkeld voor de preventie van cervixcarcinomen; later zijn de vaccins ook geregistreerd voor gebruik bij mannen en voor de preventie van carcinomen van de anus, vulva en vagina.
In Nederland zijn twee vaccins op de markt: Cervarix van GlaxoSmithKline (bivalent) en Gardasil van Merck MSD (quadrivalent). In Amerika wordt alleen het nonavalente Gardasil-9 gebruikt. Tevens worden er therapeutische vaccins ontwikkeld, voor bestaande infecties.13 Op basis van aanbesteding is gekozen voor Cervarix in het RVP; de Gezondheidsraad sprak geen voorkeur uit. Er werd wel gezien dat Cervarix tot hogere antistoftiters leidt, maar wat dat betekent voor de mate van bescherming tegen HPV-infectie was toen niet duidelijk (tabel 2).
Groot-Brittannië is in 2011 overgestapt van Cervarix naar Gardasil, omdat dit vaccin ook bescherming biedt tegen genitale wratten. In 2013 concludeerden Nederlandse onderzoekers van het Nivel en het UMCG dat Gardasil zijn hogere prijs waard kan zijn, vanwege de bescherming tegen genitale wratten en een nieuw gevonden kruisbescherming tegen andere typen HPV. De tweede aanbesteding in 2012 was echter al in gang gezet, en met de bescherming tegen cervixcarcinoom als primair eindpunt werd opnieuw gekozen voor Cervarix.15
Invoering in het Rijksvaccinatieprogramma
In 2009 is vaccinatie met het HPV-vaccin van start gegaan in Nederland met een inhaalcampagne voor meisjes geboren tussen 1993 en 1996. In 2010 is het opgenomen in het RVP, voor meisjes van 12 jaar. Het advies van de Gezondheidsraad (GR) van 31 maart 2008 was hiervoor de aanleiding: die oordeelde dat de vaccinatie kosteneffectief is en het jaarlijks zo’n honderd sterfgevallen zou kunnen voorkomen. Wel stelde de GR als voorwaarde dat een monitoringsprogramma werd opgezet om de effectiviteit, beschermingsduur, veiligheid en acceptatie te blijven onderzoeken.
De introductie van het HPV-vaccin werd begeleid door veel voorlichting. De GR had al verwachtingen uitgesproken dat de acceptatie van de HPV-vaccinatie niet zonder slag of stoot zou gaan. Het ging om een nieuw vaccin, geproduceerd met nieuwe technologie, zonder directe onderzoeksresultaten over de effectiviteit op lange termijn. Mogelijk zeldzame bijwerkingen konden om deze reden nog niet worden uitgesloten. Het onderzoek dat er wel was, was uitgevoerd bij adolescenten. Het directe voordeel voor de meisjes was ook minder zichtbaar: het ging niet om het voorkomen van een kinderziekte, maar om een ziekte die pas na vele jaren ontstaat, en die ook nog eens een relatie heeft met seksueel gedrag. De kosteneffectiviteit was nog onzeker en typevervanging (een toename van infecties met HPV-types die niet in het vaccin zitten) was niet uit te sluiten. Al deze onzekerheden werden benoemd door de GR, maar stonden volgens hen introductie niet in de weg. Tegenstanders van de vaccinatie grepen deze onzekerheden aan als hun voornaamste tegenargumenten. Ook vooraanstaande wetenschappers uitten hun bezwaren.16 Hoewel de inhaalcampagne goed van start ging, daalde de opkomst al snel (52,5 procent). Dit was niet alleen het geval in Nederland, want volgens het Europese infectieziekte-instituut ECDC viel in vrijwel heel Europa de opkomst tegen, met name door negatieve berichtgeving in de media.
Geleidelijk ontstond er rust in de media, onder andere doordat het RIVM de voorlichtingscampagne had aangepast en meer ruimte liet voor twijfels en persoonlijke afwegingen. De vaccinatiegraad steeg de daaropvolgende jaren licht naar 61 procent. Vanaf 2016 trad echter weer een daling op. In 2018 was 45,5 procent van de meisjes voldoende gevaccineerd (figuur 1). De belangrijkste reden om niet te vaccineren blijkt onzekerheid over de bijwerkingen te zijn.
Introductie in overige landen
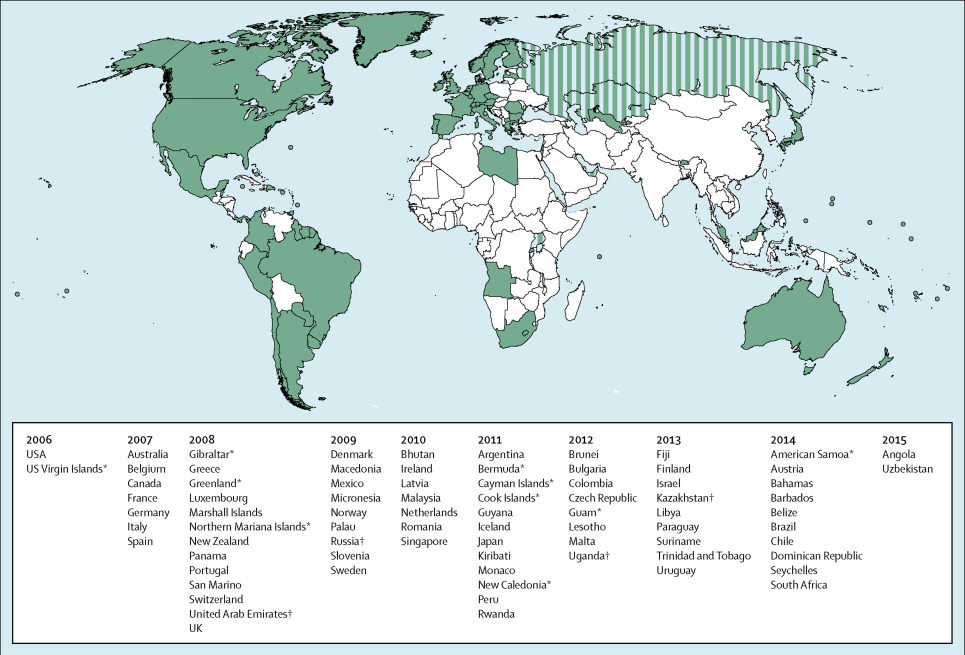
Sinds 2006 hebben wereldwijd meer dan 80 landen een HPV-vaccinatieprogramma geïmplementeerd (figuur 2). Tussen 2006 en 2014 werden naar schatting 118 miljoen vrouwen gevaccineerd. Slechts 1 procent van hen kwam uit een laag-inkomenland. 70 procent van alle gevaccineerden kwam uit een hoog-inkomenland, terwijl slechts 14 procent van de nieuwe cervixcarcinomen uit hoog-inkomenlanden komt.17
Ondanks het hoge aantal gevaccineerde vrouwen tussen 2006 en 2014 heeft een groot deel van de wereldbevolking nog steeds niet de mogelijkheid om tegen HPV gevaccineerd te worden. De huidige vaccinatieprogramma’s bereiken 12 procent van alle jong-adolescente vrouwen wereldwijd.
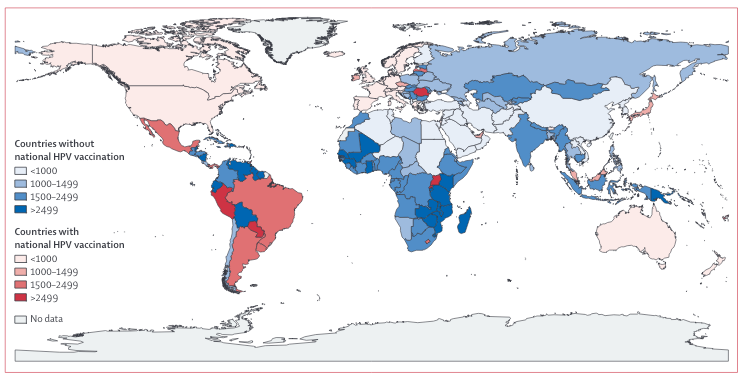
Landen die nu nog geen vaccinatieprogramma’s hebben zouden de meeste gezondheidswinst boeken bij introductie van een HPV-programma, omdat hier een grotere proportie cervixcarcinoom en sterfte kan worden voorkomen. Het gaat hierbij vooral om landen in Afrika en Azië (figuur 3).17,18
Groot-Brittannië
In Groot-Brittannië werd de HPV-vaccinatie in 2008 opgenomen in het landelijke vaccinatieprogramma voor meisjes van 12 en 13 jaar. Het eerste jaar was de vaccinatiegraad 80 procent.19 De jaren daarna daalde deze licht. Verklaringen hiervoor zijn negatieve publiciteit (overlijden van een tiener na een HPV-vaccinatie, waarvoor geen causaal verband werd aangetoond) en de H1N1-pandemie, waardoor de vaccinatiecentra minder tijd hadden om de HPV-vaccinaties uit te voeren. In 2016/2017 was de vaccinatiegraad 83 procent.20 In het schooljaar 2019/2020 werd de vaccinatie ook voor 12- en 13-jarige jongens opgenomen. Sinds april 2018 komen ook mannen die seks hebben met mannen (MSM) en transgenders tot een leeftijd van 45 jaar in aanmerking voor gratis HPV-vaccinaties.21 De vaccinatiegraad voor andere vaccinaties is vergelijkbaar met Nederland.22
Duitsland
In 2007 werd een drie-dosisschema HPV-vaccinatie geadviseerd aan alle meisjes tussen de 12 en 17 jaar. In de eerste jaren was veel controverse rondom deze vaccinatie. In 2007 overleden twee meisjes, in Duitsland en in Oostenrijk, vlak nadat zij de HPV-vaccinatie kregen. Ondanks dat geen causaal verband werd gevonden beïnvloedde dit de publieke opinie over de vaccinatie. Daarnaast vond men dat de aanbevelingen voor vaccinatie al gedaan waren voordat de effectiviteit voldoende was aangetoond in grote studies, omdat het Duitse Geneesmiddelen-instituut niet het cervixcarcinoom, maar de voorlopers ervan als uitkomstmaat gebruikte. Overigens werd deze uitkomstmaat in andere landen ook gebruikt en acceptabel gevonden, vanuit de aanname dat een vaccin dat bescherming biedt tegen een voorloper ook bescherming biedt tegen cervixcarcinoom zelf.
De vaccinatiegraad voor HPV in Duitsland daalde van 40 naar 10 procent en steeg in 2015 naar 45 procent. Inmiddels is de leeftijd voor deze vaccinatie vervroegd naar 9 tot 14 jaar, omdat de kosteneffectiviteit bij deze leeftijd hoger is. Een mogelijke verklaring voor de lage vaccinatiegraad is dat de vaccinatie door de doelgroep zelf bij de huisarts gehaald moet worden. Er is geen rijksvaccinatieprogramma van waaruit deze vaccinaties worden aangeboden.22 Sinds 2018 wordt geadviseerd om ook jongens tegen HPV te vaccineren en wordt een twee-dosisschema gehanteerd.23,24
De vaccinatiegraad voor de overige vaccinaties in Duitsland is vergelijkbaar met die in Nederland, volgens OECD-data. In Duitsland wordt de vaccinatiegraad echter alleen nagevraagd bij het starten op de basisschool (5 en 6 jaar), hetgeen mogelijk geen accuraat beeld geeft.
België
In 2010 werd Gardasil opgenomen in het basisvaccinatieprogramma in Vlaanderen voor meisjes in het eerste leerjaar van de middelbare school. De vaccinatiegraad in Vlaanderen voor HPV-vaccinaties is hoog, 90 procent.25 Een mogelijke verklaring voor deze hoge vaccinatiegraad is dat meisjes in Vlaanderen op het moment dat ze twaalf jaar worden een persoonlijke uitnodiging krijgen om zich dan te laten vaccineren. In Nederland worden meisjes meestal maar twee keer per jaar massaal opgeroepen voor deze vaccinatie, waardoor de collectieve opinie meer invloed heeft op de individuele besluitvorming.26 Voor Brussel en Wallonië is de vaccinatiegraad voor HPV niet bekend. Er wordt alleen in het Franstalige deel van België eens in de vier jaar een steekproef naar de vaccinatiegraad gehouden onder scholieren. In 2017 was de vaccinatiegraad met 36,1 procent in Franstalig België laag.27
Sinds schooljaar 2019/2020 worden ook jongens opgeroepen in Vlaanderen voor HPV-vaccinaties.28
In Vlaanderen geldt dat de vaccinatiegraad voor de overige vaccinaties net iets hoger ligt dan in Nederland. Ook hier worden vaccinaties gegeven bij de consultatiebureaus.
Australië
Australië voerde in 2007 als een van de eerste landen een nationaal vaccinatieprogramma in voor meisjes en in 2013 werden hier als eerste de jongens toegevoegd aan het programma. Australië kent een hoge vaccinatiegraad voor HPV. Bij meisjes is de vaccinatiegraad voor het driedosisschema 80 procent; voor jongens 76 procent. De successen van het programma worden toegeschreven aan een hoge acceptatie voor de vaccinatie in de algehele populatie, een genderneutrale aanpak en het aanbod van de vaccinaties via een schoolprogramma.
Ondanks dit nu al succesvolle programma is besloten om over te stappen van Gardasil naar Gardasil-9. Met de verwachting dat hierdoor de vaccinatiegraad nog verder zal stijgen en de circulatie van HPV nog verder zal dalen.29
10 jaar verder - Wat levert het vaccin op?
Een Cochrane review naar de effectiviteit en bijwerkingen van de HPV-vaccinatie werd in 2018 gepubliceerd. In deze review is gekeken naar het beschermende effect van de HPV-vaccinatie op cervixcarcinoom en de voorstadia hiervan. Zesentwintig studies met ruim 73.000 adolescente vrouwen werden geïncludeerd. De follow-up van deze studies varieerde van een half jaar tot acht jaar. Er werden geen studies gevonden die cervixcarcinoom als uitkomstmaat hadden, enkel de voorstadia ervan. Bij de beoordeling van het effect van de vaccinatie werd een onderscheid gemaakt in de HPV-status bij aanvang van de studies.30
HPV-negatieve vrouwen
Bij HPV-DNA-negatieve vrouwen tussen 15 en 26 jaar werd een hoge mate van bewijs gevonden dat vaccinatie de ontwikkeling van CIN2+ en CIN3+, veroorzaakt door HPV-16 en HPV-18, voorkomt (respectievelijk van 164 naar 2/10.000 en van 70 naar 0/10.000). Er werd een matig bewijs gevonden dat vaccinatie adenocarcinoma in situ (AIS) voorkomt (van 9 naar 0/10.000). Onafhankelijk van het type HPV heeft vaccinatie ook een beschermend effect op de ontwikkeling van de voorstadia van cervixcarcinoom. Voor CIN2+ is hier een hoge mate van bewijs voor (van 287 naar 106/10.000). Voor AIS is dit bewijs matig (van 10 naar 0/10.000). Voor CIN3+ is de uitkomst afhankelijk van het gebruikte vaccin: voor het bivalente vaccin is er een hoge mate van bewijs (RR 0.08), voor het quadrivalente vaccin is er een matig bewijs (RR 0.54).30
HPV-status onbekend
Er werden studies gevonden bij vrouwen tussen 15 en 26 jaar met een onbekende HPV-status. Ook hier werd een hoge mate van bewijs gevonden dat vaccinatie de ontwikkeling van CIN2+, CIN3+ en AIS op basis van HPV-16 en HPV-18 voorkomt (voor CIN2+ en CIN3+ van 341 naar 157/10.000 en voor AIS van 14 naar 5/10.000). Ongeacht het type HPV is er een hoge mate van bewijs dat vaccinatie de ontwikkeling van CIN2+ en AIS voorkomt (respectievelijk van 559 naar 391/10.000 en van 17 naar 5/10.000). Voor CIN3+ geldt hier ook dat de uitkomst afhankelijk is van het gebruikte vaccin. Voor het bivalente vaccin is een hoge mate van bewijs en voor het quadrivalente vaccin is een matig bewijs.
Bij vrouwen in de leeftijdsgroep tussen 24 en 45 jaar is een matig bewijs dat vaccinatie de ontwikkeling van CIN2+ voorkomt, zowel voor HPV-16 en HPV-18 als voor ieder type HPV (RR 0,74 en RR 1,04). Mogelijk komt dit doordat al eerder blootstelling aan HPV is geweest. Voor CIN3+ en AIS zijn geen data bekend in deze leeftijdsgroep.30
Bijwerkingen
Zowel in de controlegroepen (placebo of andere vaccinatie) als in de HPV-vaccinatiegroep is de kans op ernstige bijwerkingen voor alle leeftijden gelijk (669 versus 656/10.000). De meest gerapporteerde klachten in beide groepen zijn pijn, zwelling en roodheid rondom de injectieplaats.30
Na media-aandacht voor (chronische) vermoeidheid na toediening van het HPV-vaccin kwamen in 2015 flink meer meldingen bij het LAREB binnen over langdurige vermoeidheidsklachten na de HPV-vaccinatie. Inmiddels is uit een grootschalig onderzoek onder 70.000 meisjes gebleken dat er na invoering van het vaccin niet méér meisjes met (chronische) vermoeidheidsklachten zijn dan voor de invoering van het HPV-vaccin.31
Kosteneffectiviteit
Om kosteneffectief te zijn, wordt bij de HPV-vaccinatie van meisjes een ondergrens van een vaccinatiegraad van 70 procent aangehouden. De meest uitgebreide preventiestrategie tegen cervixcarcinoom is de combinatie van een vaccinatieprogramma met een hoogwaardig screeningsprogramma. Deze combinatie wordt voornamelijk in hoog-inkomenlanden ingezet.17
Een meta-analyse heeft laten zien dat een vaccinatiegraad van minimaal 50 procent zorgt voor een afname van 68 procent voor infectie met HPV-16 en HPV-18, en voor een afname van 61 procent van het hebben van anogenitale wratten. Bij een vaccinatiegraad boven de 50 procent wordt ook groepsimmuniteit gezien: in landen met een hoge vaccinatiegraad komen anogenitale wratten bij jongens en oudere vrouwen minder voor.32
In Nederland is de vaccinatiegraad voor HPV sinds de invoering maximaal 61 procent geweest. Op dit moment is de vaccinatiegraad slechts 45,5 procent (2018). Om de voordelen van groepsimmuniteit te benutten en om kosteneffectief te zijn, zal dus nog actie ondernomen moeten worden om de vaccinatiegraad te verhogen.
Toekomst
Adviesaanvraag Gezondheidsraad over de HPV-vaccinatie, inclusief vaccinatie voor jongens
De minister van VWS heeft een adviesaanvraag gestuurd aan de GR, naar aanleiding van nieuwe informatie over de vaccinaties. De GR is gevraagd te adviseren over eventuele aanpassing van het type vaccin, de wenselijkheid van vaccinatie van jongens en of herziening van de leeftijd van vaccinatie aanvaardbaar en effectief is. In juni 2019 is het advies verschenen en het is aan de minister van VWS om het advies al dan niet over te nemen. Dit besluit wordt in het najaar van 2019 verwacht.
De GR adviseert om vaccinatie tegen HPV te behouden binnen het RVP. De vaccinatie zou aangeboden moeten worden aan zowel meisjes als jongens, zo dicht mogelijk bij de leeftijd van 9 jaar. De GR adviseert tevens een aanvullend vaccinatieprogramma op te zetten voor mensen tot en met 26 jaar.
De GR concludeert dat alle drie de beschikbare vaccins veilig en effectief zijn en geeft hier verder geen aanbeveling over.
Vooruitlopend op dit besluit is besloten om dit najaar alle 16- en 17-jarige meisjes extra op te roepen die nog niet eerder voor HPV gevaccineerd zijn. Het gaat hierbij om 80.000 extra op te roepen jongeren.33