Samenvatting
De antimicrobial stewardshipmonitor van de SWAB verzamelt twee soorten monitoringsinformatie: 1) informatie over de kwaliteit van het antibioticumgebruik; en 2) informatie over de activiteiten die Nederlandse A-teams verrichten om de kwaliteit te meten en te verbeteren. Op nationaal niveau verschaft de monitor inzicht in het effect en het proces van het uitoefenen van antimicrobial stewardship. De antimicrobial stewardshipmonitor rapporteert in Nethmap. De antimicrobial stewardshipmonitor en de twee andere pijlers van Nethmap (resistentiedata en kwantitatief antibioticumgebruik) geven ieder vroegtijdig unieke signalen af die helpen om de behandelbaarheid van infecties bij patiënten zo lang mogelijk te waarborgen. Voor individuele ziekenhuizen levert de monitor spiegelinformatie op waardoor ziekenhuizen van elkaar kunnen leren. Het inzichtelijk maken van de kwaliteit van antibioticumgebruik is tevens het startpunt van lokale verbeterinterventies. Een pilot in 2017 liet zien dat het haalbaar is om uit het elektronische patiëntendossier automatisch data te extraheren waarmee kwaliteitsindicatoren voor de volgende drie deelaspecten van correct antibioticumgebruik worden berekend: 1) schrijf reservemiddelen voor volgens de lokale richtlijn; 2) verricht een tijdige iv-orale switch; 3) verricht een bedsideconsult bij een Staphylococcus aureus-bacteriëmie. Afwezigheid van discrete data maakte wel dat sommige gegevens handmatig aangevuld dienden te worden en onderbezetting van ICT-afdelingen bleek eveneens een barrière. De antimicrobial stewardshipmonitor zal zich geleidelijk uitbreiden over de Nederlandse ziekenhuizen om A-teams te ondersteunen bij het optimaliseren van het antibioticumgebruik.
Summary
The SWAB antimicrobial stewardship monitor collects two types of monitoring information: 1) information on the quality of antibiotic use, and 2) information on the activities that Dutch A-teams perform to measure and improve quality. On a national level, the monitor provides insight into both the effect and the process of performing antimicrobial stewardship. The antimicrobial results of the stewardship monitor are reported in Nethmap. The antimicrobial stewardship monitor and the two other pillars of Nethmap (resistance data and quantitative antibiotic use) are all three early indicators that help to ensure future treatment of infections. For individual hospitals, the monitor provides a benchmark enabling to learn from each other by exchanging experiences. Information on the quality of antibiotic use is also the starting point for local improvement interventions. A pilot in 2017 showed that it is feasible to automatically extract data from electronic medical records to calculate quality indicators for the following three aspects of antibiotic use. 1) prescribe restricted antimicrobials according to the local guidelines; and 2) perform timely iv-oral switch; and 3) perform bedside consultation in patients with Staphylococcus aureus bacteraemia. The absence of discrete data meant that some data had to be complemented manually. Lack of support from hospital IT departments also proved to be a barrier. The antimicrobial stewardship monitor will gradually expand over Dutch hospitals and will continue to support A-team in their efforts to optimize antibiotic use.
Achtergrond
Antibioticumresistentie is een groot probleem dat de gezondheidszorg in haar huidige vorm bedreigt.1 Dit geldt ook voor Nederland. Tweede- en derdegeneratie cefalosporines, de hoeksteen van de behandeling van ernstige infecties, zijn onwerkzaam bij 6 tot 12 procent van de E. coli-infecties.2 De tegelijkertijd optredende resistentie voor ciprofloxacine (12 procent gemiddeld, maar tot 23 procent op urologieafdelingen), maakt dat infecties in toenemende mate niet meer te behandelen zijn met orale middelen, met langere opnames en infuusgerelateerde complicaties tot gevolg.
De belangrijkste drijver van antibioticumresistentie is onjuist (onnodig, te breed, te lang) gebruik van antibiotica. Een recente Nederlandse studie laat zien dat minder dan 50 procent van alle antibioticumvoorschriften aan meer dan de helft van alle aspecten van goed antibioticumgebruik voldoet.3 Een zorgelijke ontwikkeling is eveneens dat er een forse toename is van het gebruik van reserveantibiotica zoals carbapenems, die geen tred houdt met de ontwikkeling van resistentie van gramnegatieve micro-organismen.2
Antimicrobial stewardship streeft optimalisatie van antibioticumgebruik na. Beteugeling van antibioticumresistentie is één, maar niet het enige, beoogde effect. Verbetering van patiëntenuitkomsten, afname van bijwerkingen en optimaliseren van de inzet van middelen zijn andere doelstellingen.4 Sinds 2014 zijn in Nederlandse ziekenhuizen antibioticateams (A-teams) actief, die verantwoordelijk zijn voor de implementatie van een antimicrobial stewardshipprogramma’s (zie het artikel van Marlies Hulscher in ditzelfde nummer). Ook vóór 2014 zetten de kernleden van het A-team (arts-microbioloog, internist-infectioloog en ziekenhuisapotheker) zich in om juist antibioticumgebruik te faciliteren, maar er is een verschil. Antimicrobial stewardship onderscheidt zich omdat het – in plaats van zuiver door diagnostiek en consultvraag gedreven adviezen – een samenhangende proactieve inzet van A-teamleden vergt, waarbij de gehele kwaliteitscyclus centraal staat: het structureel meten en documenteren van de kwaliteit van antibioticumgebruik, waarnodig gevolgd door het inzetten van een verbetertraject.4,5
De Stichting Werkgroep AntibioticaBeleid (SWAB) heeft een werkgroep Antimicrobial stewardship die onder ander nastreeft om A-teams te faciliteren bij het bewaken van de kwaliteit van het lokale antibioticumgebruik. De antimicrobial stewardshipmonitor is er hier een voorbeeld van.6
Antimicrobial stewardshipmonitor
De antimicrobial stewardshipmonitor verzamelt twee soorten monitoringsinformatie: 1) informatie over de kwaliteit van het antibioticumgebruik gemeten aan de hand van een aantal kwaliteitsindicatoren; en 2) informatie over de activiteiten die Nederlandse A-teams verrichten om de kwaliteit te meten en te verbeteren.
Op nationaal niveau verschaft de monitor inzicht in het effect en het proces van het uitoefenen van antimicrobial stewardship. De antimicrobial stewardshipmonitor biedt een essentiële toevoeging aan informatie over antibioticumgebruik en resistentie, zoals die reeds jaarlijks gerapporteerd wordt in Nethmap. Informatie over de kwaliteit van antibioticumgebruik zoals beoordeeld door A-teams vergemakkelijkt de interpretatie van het totale (kwantitatieve) antibioticumgebruik. Daarnaast biedt de toevoeging van de stewardshipmonitor de mogelijkheid om het aantal en type activiteiten van A-teams te koppelen aan veranderingen in kwantiteit en kwaliteit van antibioticumgebruik. Tot slot geeft de integratie van deze drie pijlers inzicht in het effect van de inzet van A-teams op de (verandering in) kwaliteit van antibioticumbeleid op de resistentieontwikkeling. Deze drie verschillende monitoringsinstrumenten geven dus ieder vroegtijdig unieke signalen af die helpen om de behandelbaarheid van infecties bij patiënten zo lang mogelijk te waarborgen. Deze monitoringsinformatie is van belang om het beleid van instanties die betrokken zijn bij het bestrijden van de ontwikkeling van antimicrobiële resistentie, waaronder de SWAB, te evalueren en te sturen.
Daarnaast is de monitoringsinformatie essentieel voor individuele ziekenhuizen. Deze kan gebruikt worden als spiegelinformatie waarbij ziekenhuizen van elkaar kunnen leren. Het meten van de kwaliteit van antibioticumgebruik en het inzichtelijk maken hiervan zijn tevens van het startpunt van lokale verbeterinterventies binnen een kwaliteitscyclus (plan-do-study-act (PDSA)).
De activiteiten die Nederlandse A-teams verrichten om de kwaliteit te meten en te verbeteren worden jaarlijks geïnventariseerd via een digitale vragenlijst. In dit artikel richten we ons verder vooral op de kwaliteit van het antibioticumgebruik.
Verzameling van data over de kwaliteit van het antibioticumgebruik
Data over de kwaliteit van antibioticumgebruik worden sinds 2015 verzameld en werden voor het eerst gepubliceerd in Nethmap 2016. Idealiter wordt het oordeel over de kwaliteit van het antibioticumgebruik door het A-team vastgelegd tijdens de dagelijkse werkzaamheden en worden deze data samen met de reeds vastgelegde gegevens over middel, dosering, toedieningsroute en behandelduur, uit het elektronische patiëntendossier (epd) geëxtraheerd, zodat extra handwerk vermeden wordt. Van oktober tot en met december 2017 heeft er een pilot plaatsgevonden in tien ziekenhuizen om de haalbaarheid van automatische data-extractie vanuit het epd te testen. Indien gewenst konden ziekenhuizen handmatig data aanvullen. De dataverzameling richtte zich – gebaseerd op een eerdere prioritering door A-teams – op de volgende drie kernaanbevelingen voor correct antibioticumgebruik (oftewel: stewardshipdoelen): 1) schrijf reservemiddelen voor volgens de lokale richtlijn; 2) verricht een tijdige iv-orale switch; 3) verricht een bedsideconsult bij een Staphylococcus aureus-bacteriëmie. Acht van de tien ziekenhuizen bleken in staat om data over ten minste een van de drie stewardshipdoelen aan te leveren. Eén ziekenhuis had onvoldoende ICT-capaciteit en één ziekenhuis kreeg uiteindelijk geen toestemming van de raad van bestuur om te participeren. Drie ziekenhuizen leverden alleen elektronisch data aan, drie alleen handmatig en twee zowel elektronisch als handmatig.
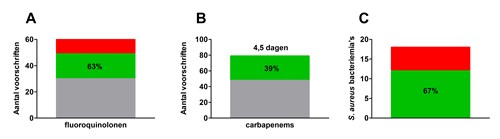
De pilot heeft laten zien dat data-extractie voor het monitoren van bovengenoemde stewardshipdoelen mogelijk is en dat daarmee, op ziekenhuisniveau, scores berekend kunnen worden die een indicatie geven van de kwaliteit van het antibioticumgebruik (figuur 1).
Antibioticumvoorschriften konden uit het epd geëxtraheerd worden en op patiëntniveau aan elkaar geregen worden tot een ‘antibioticumkuur’. In het voorbeeld in figuur 1a heeft het A-team de helft van alle kuren ciprofloxacine op juistheid beoordeeld en hiervan bleek 63 procent van de kuren de indicatie terecht. Geen van de participerende A-teams was in staat om de beoordeling automatisch aan te leveren, deze is handmatig aangevuld. Als afgeleide (‘proxy’) van tijdige iv-orale switch konden met behulp van de door de A-teams elektronisch aangeleverde data wel twee andere soorten uitkomsten worden berekend. Deze uitkomsten gaven informatie over de combinatie van iv-orale switch en stoppen van intraveneuze antibiotica. Ten eerste, de gemiddelde duur van intraveneuze toediening en ten tweede, het percentage patiënten dat binnen 72 uur gestopt of geswitcht was (figuur 1b). Het bleek mogelijk om het aantal unieke S. aureus-bacteriëmieën uit het epd te extraheren. Of een bedsideconsult wel of niet verricht was, moest wel handmatig aangevuld worden (figuur 1c).
Ook al bleek het technisch mogelijk om relevante data te extraheren en te verwerken, er werden hierbij wel barrières ervaren. Afwezigheid van discrete variabelen, zoals de beoordeling van juistheid van een voorschrift, maakten het noodzakelijk om gegevens handmatig aan te vullen. Deze beoordelingen door het A-team werden of vaak buiten het epd vastgelegd of als vrije tekst in het epd zodat deze data niet automatisch eruit gehaald konden worden. Data-extractie uit het epd kost het A-team niet meer inspanning, maar het bezorgt de ICT-afdeling wel meer werk. Vanwege de (over)belasting van de ICT-afdelingen in het land en de beperkte aan A-teams toegekende ICT-ondersteuning was de data-extractie een belangrijke belemmerende factor.
Kwaliteitscyclus
Het is essentieel om twee kernaspecten binnen antimicrobial stewardship te onderscheiden. Ten eerste zijn er de stewardshipdoelen, die goed antibioticumgebruik, wat betreft indicatie, keuze van het middel, dosering, toedieningsweg en therapieduur bij patiënten in het ziekenhuis beschrijven (je zou dit het ‘wat’ van antimicrobial stewardship kunnen noemen).7,8 Het A-team maakt uit deze steward-shipdoelen een keuze waarop het zich richt.
Het bereiken van deze stewardshipdoelen laat in de praktijk helaas vaak te wensen over. Er bestaat een structurele discrepantie tussen de zorg die beschreven is in richtlijnen voor optimaal antibioticumgebruik en de daadwerkelijk geleverde zorg.3 Om dit gat te dichten staat een arsenaal aan stewardshipinterventies de A-teams ter beschikking om het voorschrijfgedrag te verbeteren: (het zogeheten ‘hoe’ van antimicrobial stewardship).7 Dit is het tweede kernaspect binnen antimicrobial steward-ship.
Talrijke studies tonen aan dat alle soorten interventies gericht op gedragsverandering ongeacht het karakter (restrictief, persuasief of structureel) voorschrijvers ertoe kunnen aanzetten antibiotica beter te gebruiken.7,9 De effecten in studies lopen echter uiteen. Dit wordt niet bepaald door de interventie zelf, maar vooral door de mate waarin de keuze van de interventie(s) past bij de setting waarin ze worden ingevoerd. Met andere woorden, de keuze van de interventie dient ingegeven te worden door de determinanten die de kwaliteit van de huidige zorg beïnvloeden.10 Ter illustratie: educatie zal niet effectief zijn om de empirische behandeling van pneumonie door longartsen te verbeteren als niet kennisgebrek maar een gebrek aan motivatie om richtlijnen te volgen hieraan ten grondslag ligt; het inzetten van een lokale opinieleider kan dan mogelijk wel effectief zijn. Een ander voorbeeld: de kans is groter dat bloedkweken beter afgenomen worden als SEH-verpleegkundigen geschoold worden en bloedkweekflesjes op de prikkar liggen; beter dan wanneer aiossen die werken op de SEH hierover een zakkaartje krijgen.
Figuur 2 vat de stappen samen die A-teams dienen te doorlopen bij het verbeteren van antibioticumgebruik. De tweede stap is de diagnostische fase en deze is cruciaal voor het selecteren van de juiste verbeterinterventies. Op verschillende niveaus (cultureel, organisatorisch als het gaat om patiëntenzorg, individuele professionals (bijvoorbeeld kennis en attitude)) kunnen bevorderende en belemmerende factoren, samen determinanten, van goed antibioticumgebruik bestaan.11
De stewardshipmonitor verschaft ziekenhuizen inzicht in de kwaliteit van antibioticumgebruik. De vergelijkende data tussen ziekenhuizen stellen A-teams in staat problemen te identificeren, zowel wat betreft stewardshipdoel (bijvoorbeeld weinig iv-orale switch) als patiëntencategorie (bijvoorbeeld afdeling, middel, ziektebeeld). A-teams kunnen dan de probleemgebieden prioriteren, de oorzaak van de verminderde kwaliteit van antibioticumgebruik analyseren (een zogeheten barrière-analyse) en uiteindelijk een op maat gesneden verbeterinterventie doen.
Toekomst
De inzet van A-teams om antibioticumgebruik te verbeteren is effectief, maar kost tijd en dus geld. Gebrek aan financiering en menskracht is een belangrijke barrière voor implementatie van een antimicrobial stewardshipprogramma12. Financiële ondersteuning is essentieel gebleken voor een volwaardig stewardshipprogramma.13 Bovendien is er een positieve associatie tussen het aantal toegewezen fte voor stewardship en (zelfgerapporteerde) effectiviteit.14 Ook in Nederland liet een pilot in 2015 onder vijf A-teams zien dat tijdgebrek een belemmering vormde om de kwaliteit van antibioticumgebruik te monitoren, te documenteren en te rapporteren.6 De jaarlijkse inventarisatie in 2017 liet zien dat 41 procent van de A-teams financiële ondersteuning van de raad van bestuur kreeg, voor gemiddeld 0,5 fte. Dit ligt ver onder de vastgestelde norm voor Nederlandse ziekenhuizen (Zie het artikel van Marlies Hulscher in ditzelfde nummer) en vraagt om een gecontinueerde inzet van de lokale A-teams om de raad van bestuur te bewegen tot (meer) financiële ondersteuning en blijvende nationale belangenbehartiging.
Wat betreft de rapportage van data heeft er een verschuiving van werklast plaatsgevonden. Dubbele handmatige rapportage door A-teamleden wordt bij voorkeur vervangen door data-extractie uit het epd. Dit gebeurt door een ICT-afdeling en ook dat kost tijd. Helaas blijkt dat slechts 66 procent van de A-teams ICT-ondersteuning heeft, waarvan maar 9 procent structureel is. A-teams zullen, zowel om de werkprocessen te optimaliseren als om inzicht te verkrijgen in de kwaliteit van antibioticumgebruik, structurele ICT-capaciteit moeten toevoegen aan hun team.
Data-extractie uit een epd kan alleen plaatsvinden als die data discreet vastgelegd zijn. Tot nu toe ontbreekt het in epd’s vooral aan een mogelijkheid om het kwaliteitsoordeel van het A-team, het al dan niet gegeven advies en het oordeel of het advies opgevolgd is, vast te leggen. Daarnaast wordt de (werk)diagnose doorgaans in vrije tekst vastgelegd, als die al gedocumenteerd wordt. Er zijn landelijke initiatieven om voor de grotere epd’s in het land (EPIC, Chipsoft, Nexus) dit probleem aan te pakken, waarbij uiteraard het gebruik van uniforme definities wordt nagestreefd.
Hiernaast zijn er uitdagingen om ziekenhuizen met elkaar te vergelijken. Hoe corrigeer je voor verschillen in casemix en hoe ga je om met de (wenselijke) selectie die A-teams maken voor beoordeling van antibioticumgebruik? Veel A-teams gebruiken klinische beslisregels om de dagelijkse monitoring te beperken tot de groep patiënten waarmee de meeste winst te behalen valt. Het percentage onjuist gebruik neemt dan uiteraard toe ten opzichte van ziekenhuizen die geen voorselectie maken.
Data worden, met inachtneming van de bestaande regelgeving, aangeleverd aan een dataverwerker en deze maakt rapportages zoals boven beschreven. De huidige rapportages zijn nog betrekkelijk summier en zullen in de komende jaren uitgebreid worden. Het streven is een dasboard te ontwikkelen waar A-teams zelf een selectie kunnen maken van de beschikbare gegevens en hun benchmark kunnen kiezen.
De Nederlandse ziekenhuizen zijn voortvarend aan de slag gegaan met de oprichting van A-teams en de implementatie van lokale antimicrobial stewardshipprogramma’s. Naast nuttige informatie op landelijk niveau, ontwikkelt de antimicrobial stewardshipmonitor zich tot een instrument dat A-teams in staat stelt om inzicht te krijgen in de kwaliteit van het antibioticumgebruik, een essentiële stap om de kwaliteit daadwerkelijk te kunnen verbeteren.