Samenvatting
Bij het vormgeven en uitvoeren van een antimicrobial stewardshipprogramma is het belangrijk om drie programmacomponenten te onderscheiden:
- de structurele randvoorwaarden om stewardship te kunnen uitvoeren in een ziekenhuis;
- de stewardshipdoelen oftewel de deelaspecten van ‘correct antibioticumgebruik’ – door professionals, bij patiënten – waarop het stewardshipprogramma zich richt;
- de verbeterstrategieën van stewardship oftewel de door het A-team in te zetten strategieën om ervoor te zorgen dat, in de dagelijkse patiëntenzorg, professionals antibiotica op correcte wijze gebruiken.
Om A-teams in de dagelijkse praktijk te ondersteunen bij het vormgeven en uitvoeren van een antimicrobial stewardshipprogramma, beschrijven we in dit artikel wat bekend is over deze componenten. We besteden hierbij met name aandacht aan de laatste component: de verbeterstrategieën. Stewardshiprichtlijnen adviseren een scala aan potentiële verbeterstrategieën om, waar nodig, de kwaliteit van het antibioticumgebruik te verbeteren. Helaas bestaat er niet één verbeterstrategie die in alle omstandigheden werkt. Belangrijke vraag is daarom: hoe selecteer je als A-team uit het palet van beschikbare verbeterstrategieën die strategie die het best kan werken in jouw specifieke omgeving?
Het antwoord op die vraag luidt: Achterhaal allereerst de belangrijkste determinanten van het huidige antibioticumgebruik en kies daarna een strategie die aansluit bij deze determinanten.
Summary
When designing and executing an antimicrobial stewardship program, it is important to distinguish three program components:
- the stewardship prerequisites, i.e. the structural preconditions for carrying out stewardship in a hospital;
- the stewardship objectives, i.e. those aspects of 'appropriate antibiotic use’– by professionals, in patients – that constitute the focus of the stewardship program;
- the stewardship improvement strategies, i.e. the strategies to be used by the A-team to ensure that, in daily patient care, professionals actually use antibiotics correctly.
In this article we describe what is known about these components, to support A-teams in the design and execution of an antimicrobial stewardship program in daily practice. We pay particular attention to the last component: the improvement strategies. Stewardship guidelines recommend a range of potential improvement strategies to improve the quality of antibiotic use where needed. Unfortunately, there is no improvement strategy that works in all circumstances. The question therefore arises: ‘How can A-teams select an improvement intervention that might work best in their specific setting (e.g. hospital or ward)?’
The answer to that question: First find out the most important determinants of current antibiotic use and then choose a strategy that fits these determinants.
Achtergrond
Beter gebruik van antibiotica is noodzakelijk om antibioticumresistentie te beteugelen.1 Bij optimaal antibioticumgebruik wordt gestreefd naar een balans tussen de heilzame en de potentieel schadelijke werking van antibiotica voor huidige en toekomstige patiënten.2 Vanuit deze wens is ’antimicrobial stewardship’ – oftewel rentmeesterschap – geïntroduceerd. Antimicrobial stewardship kan gezien worden als 'een samenhangend geheel van acties om antimicrobiële middelen te gebruiken op een manier die een duurzame toegang tot effectieve therapie garandeert voor iedereen die antimicrobiële middelen nodig heeft'.3
In de loop der jaren zijn er, vooral voor ziekenhuizen, veel richtlijnen en beleidsdocumenten gepubliceerd om het implementeren van stewardshipprogramma’s te ondersteunen.4-10 Voorbeelden hiervan zijn het SWAB-visiedocument en de SWAB-richtlijn voor Antimicrobial Stewardship.4,5 Bij het concreet vormgeven en uitvoeren van een stewardshipprogramma is het belangrijk om drie programmacomponenten te onderscheiden:
- de structurele randvoorwaarden om stewardship te kunnen uitvoeren in een ziekenhuis;
- de stewardshipdoelen oftewel de deelaspecten van ‘correct antibioticumgebruik’ – door professionals, bij patiënten – waarop het stewardshipprogramma zich richt;
- de verbeterstrategieën van stewardship oftewel de door het A-team in te zetten strategieën om ervoor te zorgen dat, in de dagelijkse patiëntenzorg, professionals antibiotica daadwerkelijk op correcte wijze gebruiken.
De SWAB-documenten maar ook andere (inter-nationale) stewardshiprichtlijnen geven voor alle drie de componenten aanbevelingen. In dit artikel beschrijven we wat er bekend is over deze componenten om A-teams te ondersteunen bij het vormgeven en uitvoeren van een antimicrobial stewardshipprogramma. We besteden met name aandacht aan de derde component omdat de richtlijnen een scala aan potentiële verbeterstrategieën aanbevelen zonder aan te geven hoe men tot de best passende keuze kan komen.
Structurele randvoorwaarden van het stewardshipprogramma
Bij het vormgeven en uitvoeren van een steward-shipprogramma dient een ziekenhuis allereerst een aantal structurele randvoorwaarden voor het bedrijven van steward-ship op orde te hebben. Zo bevelen de richtlijnen aan om op ziekenhuisniveau een multidisciplinair antibioticastewardshipteam (A-team) aan te stellen – en financieel te compenseren (zie tabel 1) – voor het meten en verbeteren van de kwaliteit van het antibioticumgebruik.4-10 Lokaal opgestelde diagnostische en therapeutische antibioticumrichtlijnen, inclusief een formularium en een lijst van reserve- en andere ‘beperkt voorschrijfbare’ antibiotica, zijn hierbij onontbeerlijk. Voor het meten en waar nodig verbeteren van de kwaliteit dient een logistieke en administratief ondersteunde infrastructuur opgezet te worden. De gerealiseerde randvoorwaarden vormen samen de eerste deelcomponent van het stewardshipprogramma.
Stewardshipdoelen
Zodra het ziekenhuis de structurele randvoorwaarden op orde heeft, dient het A-team het steward-shipprogramma inhoudelijk vorm te geven. Het A-team moet kiezen op welke deelaspecten van ‘correct antibioticumgebruik’ – bijvoorbeeld aanbevolen antibioticumgebruik door professionals, bij patiënten, met betrekking tot indicatie, keuze van geneesmiddel, dosis, route of duur van de behandeling – het zich zal richten: wat zijn de doelen van het stewardshipprogramma? Welke deelaspecten van ‘kwalitatief goed antibioticumgebruik’ wil het A-team meten en, waar nodig, verbeteren? Wat is kwalitatief goed antibioticumgebruik en hoe meet je dat?
Gedurende het afgelopen decennium hebben veel overheids- en beroepsorganisaties kwaliteitsindicatoren ontwikkeld om de kwaliteit van de patiëntenzorg te meten en te vergelijken.11,12 Kwaliteitsindicatoren zijn ‘meetbare elementen van zorg waarvoor er wetenschappelijk bewijs of consensus onder experts bestaat dat ze gebruikt kunnen worden voor het meten van (veranderingen in) de kwaliteit van zorg’.13 Indicatoren kunnen verwijzen naar aanbevolen structuren, processen of uitkomsten van zorg. Ook voor kwalitatief goed antibioticumgebruik zijn dergelijke kwaliteitsindicatoren ontwikkeld. Zo zijn er verschillende infectieziektespecifieke indicatorensets afgeleid uit Nederlandse SWAB-richtlijnen om te meten of antibiotica op de juiste manier worden gebruikt in de dagelijkse patiëntenzorg.
Onlangs verscheen er een systematisch literatuuroverzicht van gepubliceerde kwaliteitsindicatoren die correct antibioticumgebruik beschrijven bij in het ziekenhuis opgenomen volwassen patiënten.14 De 14 geïncludeerde studies beschreven samen 200 indicatoren: 17 structuur- en 183 procesindicatoren. De meest genoemde indicator (in 71 procent van de geïncludeerde studies) betrof bij individuele patiënten ‘voorschrijven van empirische antibioticumtherapie in overeenstemming met de richtlijn', gevolgd door 'een tijdige switch van intraveneuze naar orale therapie' (64 procent), 'afnemen van ten minste twee sets bloedkweken '(57 procent) en 'aanpassen naar pathogeengerichte therapie nadat kweekresultaten beschikbaar komen '(57 procent). A-teams kunnen ter inspiratie naar dit overzicht kijken en, afhankelijk van hun lokale situatie, besluiten dat het bijvoorbeeld belangrijk is dat er in hun ziekenhuis of op bepaalde afdelingen vaker correct geswitcht wordt van intraveneuze naar orale therapie en/of dat reservemiddelen alleen bij specifieke indicaties voorgeschreven worden.
De gekozen deelaspecten van correct antibioticumgebruik vormen samen de tweede deelcomponent van het stewardshipprogramma: de doelstellingen waarop het A-team zich gaat richten. Deze doelstellingen leveren het startpunt voor taak en doel van het A-team: het meten en, waar nodig, verbeteren van de kwaliteit van het antibioticumgebruik. Een meting van de huidige kwaliteit van het antibioticumgebruik is cruciaal om het verbeterpotentieel van de gekozen deelaspecten van correct gebruik vast te stellen. Daarnaast is meten onontbeerlijk om de impact van verbeteringsinspanningen te beoordelen.
Correct antibioticumgebruik in de dagelijkse praktijk en de noodzaak tot verbetering
Gezondheidszorgonderzoek laat helaas consequent zien dat veel patiënten in de dagelijkse praktijk niet de best mogelijke zorg ontvangen en dat er grote verschillen bestaan tussen de verschillende instellingen en professionals.15 Ditzelfde geldt ook voor correct antibioticumgebruik. Hoewel Nederlandse ziekenhuizen in vergelijking met andere landen prudente gebruikers van antibiotica zijn, laat Nederlands onderzoek bij herhaling zien dat de kwaliteit van antibioticumgebruik suboptimaal is en varieert tussen ziekenhuizen, afdelingen en zelfs professionals. Deze variatie is zo groot dat zij niet enkel door verschillen in patiëntenpopulaties verklaard kan worden. Spoorenberg en collega's beschreven negen deelaspecten van correct antibioticumgebruik bij patiënten die in 2008 behandeld werden voor een gecompliceerde urineweginfectie in 19 Nederlandse ziekenhuizen (38 afdelingen algemene interne en urologie).16 Zij schetsten bijvoorbeeld hoe het aandeel ‘patiënten met empirische therapie conform het lokale antibioticaboekje’ varieerde tussen afdelingen van 3 tot 87 procent (mediaan: 48 procent); nadat kweekresultaten beschikbaar kwamen, vond een aanpassing plaats naar pathogeengerichte therapie bij 77 procent van de patiënten, variërend van 35 tot 100 procent.16 Een meting in 22 Nederlandse ziekenhuizen (1890 patiënten, zeven deelaspecten van correct gebruik) liet zien dat, in 2011 en 2012, bij start van de empirische therapie slechts bij 49 procent van de patiënten kweken werden afgenomen van de vermoedelijke infectiesite (variërend van 33 tot 73 procent); deze therapie was vervolgens bij 41 procent van de patiënten (variërend van 24 tot 58 procent) conform de richtlijn.17 Ook een recente studie in negen Nederlandse ziekenhuizen liet zien dat in 2014 en 2015 bij ongeveer de helft van de 853 patiënten antibiotica correct werden gebruikt.18 Hierbij was ‘correct gebruik’ gedefinieerd als ‘gebruik dat aan ten minste de helft van de voor de patiënt van toepassing zijnde kwaliteitsindicatoren voldoet’.
Om de kwaliteit van het antibioticumgebruik in de dagelijkse praktijk te verbeteren, adviseren de stewardshiprichtlijnen een scala aan potentiële verbeterstrategieën, waaronder scholing, prospectieve audit en feedback, pop-ups in het elektronisch patiëntendossier (decision support) en automatische stoporders.4-10 Bij het vormgeven van de derde component van het stewardshipprogramma kiest het A-team de verbeterstrategieën die het wil inzetten om het voorschrijfgedrag van individuele voorschrijvers zodanig bij te sturen dat antibiotica gedurende de gehele ziekenhuisopname van de patiënt daadwerkelijk correct gebruikt worden.
De effectiviteit van verschillende strategieën om correct gebruik van antibiotica te verbeteren
Er bestaan veel – en meer dan in de steward-shiprichtlijnen genoemde– verbeterstrategieën die door A-teams kunnen worden ingezet om ervoor te zorgen dat antibiotica correct worden voorgeschreven in de dagelijkse ziekenhuispraktijk.19 De effectiviteit van deze strategieën is vastgesteld in systematische literatuur- en meta-analyses en, zoals onlangs gepubliceerd, in een systematische analyse van systematische literatuuranalyses (een ‘review van reviews’).20 De laatste publicatie geeft een overzicht van de impact van verbeterstrategieën op professioneel antibioticumgebruik, patiëntuitkomsten, microbiële uitkomsten en/of kosten. Er werden 20 artikelen gevonden die 17 systematische reviews beschrijven waarin een grote verscheidenheid aan (combinaties van) verbeterstrategieën is geëvalueerd. Alle reviews concluderen dat alle strategieën over het algemeen kunnen bewerkstelligen dat professionals antibiotica op correcte wijze gebruiken en dat microbiële uitkomsten en/of kosten verbeteren zonder negatieve impact op de patiëntveiligheid. Tegelijkertijd beschrijven ze echter grote verschillen in effectiviteit tussen studies die vergelijkbare verbeterstrategieën testten. Davey en collega’s beschrijven bijvoorbeeld hoe het effect van strategieën met als hoofdcomponent ‘de verspreiding van educatief materiaal’ varieerde van -3,1 tot 50,1 procent.21 Hetzelfde fenomeen werd gezien voor de overig onderzochte strategieën, waaronder het inzetten van reminders, feedback, verplichte orderformulieren, formularia, vereiste goedkeuring vooraf, prospectieve monitoring en advies en een gewijzigde organisatie van de zorg (bijvoorbeeld de overgang van papieren naar elektronische patiëntendossiers).21
Uit bovenstaande kan geconcludeerd worden dat elke verbeterstrategie in principe het antibioticumgebruik van professionals kan verbeteren. Wederom is deze bevinding niet uniek voor antibioticumgebruik; gezondheidszorgonderzoek laat dit consequent zien.15
De vraag die vervolgens opkomt, luidt: hoe selecteer je dan als A-team uit dit palet van verbeterstrategieën die strategie die het best kan werken in jouw specifieke omgeving (bijvoorbeeld ziekenhuis of afdeling)?
Het selecteren van passende verbeterstrategieën
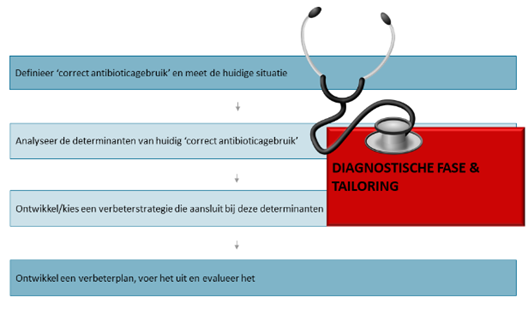
In dit opzicht is er veel te leren van de implementatiewetenschap: de wetenschappelijke studie van methoden om wetenschappelijke bevindingen in te voeren in de dagelijkse praktijk en daarmee incorrecte zorg te verminderen.22 Het invoeren van vernieuwingen en veranderingen kan worden benaderd vanuit verschillende ideeën over menselijk gedrag en het functioneren van organisaties; de implementatiewetenschap leunt dan ook zwaar op gedragswetenschappelijke theorieën. De literatuur over implementatie en gedragsverandering overziend (figuur 1),15,23,24 is een terugkerend principe voor succesvolle verandering de aanname dat de keuze van de verbeterstrategie moet aansluiten bij de determinanten die het huidige gedrag – en de mate waarmee dat in lijn is met het gewenste gedrag – beïnvloeden.
Begrip van de belangrijkste drijfveren van het huidige antibioticumvoorschrijfgedrag is cruciaal, om ideeën te genereren voor de planning van effectieve verbeterstrategieën. Succesvolle verbetering van antibioticumgebruik vereist allereerst een probleemanalyse om de determinanten van correct gebruik te achterhalen (‘de diagnostische fase’, figuur 1). Door rekening te houden met de uitkomsten van deze probleemanalyse kan vervolgens een gepaste mix van strategieën worden gekozen (‘tailoring’, figuur 1).
Helaas wordt dit maatwerkprincipe nog weinig toegepast in de keuze van verbeterstrategieën. Charani en collega’s concludeerden in hun literatuurstudie dat, hoewel onderzoek de invloed van sociale normen, attitudes en overtuigingen op voorschrijfgedrag van antibiotica liet zien, deze determinanten niet werden meegenomen in de keuze van de strategieën.25 Ook Davey en collega’s concludeerden in hun Cochrane-reviewupdate van 2017 dat ‘de mate waarin de huidige stewardshipprogramma’s gedragswetenschappelijke inzichten en benaderingen hebben geïntegreerd, beperkt is’.21 Zij adviseren dat stakeholders van steward-shipprogramma’s en onderzoeksexperts op het gebied van verbetering en sociale wetenschappen moeten worden samengebracht om meer impactvolle stewardshipprogramma's te ontwikkelen.21
Ook deze bevinding is niet uniek voor antibioticumgebruik; gezondheidszorgonderzoek toont consequent deze omissie.15,26
Determinanten van huidig antibioticumgebruik en het selecteren van een passende verbeterstrategie
Onderzoek laat zien dat correct antibioticumgebruik in ziekenhuizen wordt beïnvloed door een samenspel van determinanten die te maken hebben met kennis en attitudes van voorschrijvers, met de manier waarop deze samenwerken, de aanwezigheid van structurele voorwaarden in de ziekenhuisorganisatie, met leiderschap en met verschillen in sociaal-culturele en sociaaleconomische factoren.2,27
In lijn met deze bevindingen worden in de algemene implementatieliteratuur de volgende categorieën van determinanten onderscheiden:28
- kenmerken van de innovatie, bijvoorbeeld de duidelijkheid of de onderbouwing van de aanbeveling;
- kenmerken van de doelgroep van professionals, bijvoorbeeld kennis, vaardigheden, attitudes, routines of persoonlijkheidskenmerken;
- kenmerken van de patiënt, bijvoorbeeld kennis, attitude, medewerking, of voorkeuren van patiënten;
- kenmerken van de sociale context/professionele interacties, bijvoorbeeld meningen van of communicatie tussen collega’s;
- kenmerken van de organisatorische context/aanwezigheid van middelen, bijvoorbeeld beschikbare middelen of voorzieningen zoals een registratiesysteem;
- capaciteit voor organisatorische verandering, bijvoorbeeld bekwaam leiderschap, of prioriteit voor verbetering;
- sociale, politieke en juridische factoren, bijvoorbeeld beleid van verzekeraars.
A-teams staan voor de uitdaging om met behulp van individuele of groepsgesprekken, vragenlijsten en/of observatie bij stakeholders te achterhalen op welke van bovengenoemde domeinen zich welke determinanten manifesteren. Dit dient men voor elk betreffend deelaspect van correct antibioticumgebruik te doen omdat de relevantie van bepaalde determinanten kan variëren bij verschillende deelaspecten van gebruik. Met andere woorden: correct switchen en correct stroomlijnen van antibiotica kan door een andere set factoren worden beïnvloed. Om determinanten systematisch te achterhalen, kunnen een A-team en andere betrokkenen gebruikmaken van een generieke determinantenchecklist die door Flottorp en collega’s is ontwikkeld.28 Zie Box 1 voor een korte beschrijving van alle werkbladen die door deze onderzoekers zijn ontwikkeld om professionals te ondersteunen bij het op pragmatische wijze ontwerpen van verbeterstrategieën om de kwaliteit van de patiëntenzorg te verbeteren. De werkbladen volgen de eerste drie stappen uit figuur 1. Een Nederlandstalig alternatief voor de determinantenlijst van Flottorp is het door TNO ontwikkelde generieke diagnose-instrument MIDI (MeetInstrument Determinanten van Innovaties).29
Vervolgens dient, wederom per deelaspect van correct antibioticumgebruik, een op maat gemaakte strategie of set van strategieën te worden gekozen die aansluit bij de resultaten van de diagnostische fase. A-teams kunnen hierbij pragmatisch, explorerend te werk gaan door te brainstormen over mogelijke oplossingen. Bij voorkeur bedenkt elk A-teamlid eerst individueel zo veel mogelijk strategieën die aansluiten bij de geïdentificeerde determinanten. Ter inspiratie kunnen de leden hierbij gebruikmaken van een Cochrane-overzicht dat alle mogelijke verbeterstrategieën omschrijft.19 Daarna dient het team tot consensus te komen over de gewenste, passende aanpak. Op deze wijze wordt voorkomen dat men kiest voor ‘de bekende weg’ en niet voor de meest geëigende weg.
Die A-teams die een samenwerking hebben gevonden met implementatie- of gedragswetenschappers kunnen voor een meer theoretische vertaalslag van determinant naar strategie kiezen. Theorieën stellen strategieontwikkelaars in staat om betere strategieën te ontwikkelen om de patiëntenzorg te verbeteren.30 Als bijvoorbeeld ‘gebrek aan kennis’ een correcte switch van intraveneuze naar orale therapie belemmert, dan is het belangrijk om naar educatieve theorieën te kijken, bijvoorbeeld naar theorieën over educatie van volwassenen. Deze benadrukken bijvoorbeeld dat professionals beter leren en meer gemotiveerd zijn om te veranderen, als ze uitgaan van problemen die ze in de dagelijkse praktijk ervaren en niet zozeer van abstracte informatie zoals bijvoorbeeld verwoord in richtlijnen. Theorieën genereren zo ideeën voor het plannen van potentieel effectieve strategieën. Twee praktische voorbeelden die een inspiratie kunnen zijn voor strategieontwikkelaars zijn te vinden in een artikel van Grol en collega's over het gebruik van theorie bij het plannen van verbeteringen in de patiëntenzorg.30
Samenvattend
Het meten en verbeteren van de kwaliteit van het ziekenhuisantibioticumgebruik zijn expliciet taak en doel van A-teams. Niet alleen het meten van correct antibioticumgebruik is uitdagend voor A-teams (zie ook het artikel Stewardshipmonitor van dr. Jaap ten Oever en collega’s). Correct voorschrijfgedrag door professionals in het ziekenhuis is een complex proces dat wordt beïnvloed door vele determinanten, waardoor het verbeteren van antibioticumgebruik een complexe uitdaging voor A-teams vormt. Er is hierbij geen superieure verbeterstrategie – geen ‘one size fits all’-strategie – voorhanden die in alle omstandigheden werkt: de uitdaging ligt in het systematisch bouwen aan een strategie die aansluit bij een zorgvuldige inventarisatie van determinanten en die berust op een coherente theoretische basis.