Samenvatting
De meeste antibiotica in de Nederlandse gezondheidszorg worden voorgeschreven in de eerste lijn. De eerste lijn heeft hiermee een sleutelpositie in het voorkomen van antibioticumresistentie. Studies in Europa tonen de belangrijkste factoren om antibioticumgebruik te reduceren. Dit artikel beschrijft bij welke infectieuze aandoeningen verdere reductie mogelijk haalbaar is. De huidige situatie ten aanzien van antibioticumresistentie wordt uitgewerkt naar ziektebeelden waar de huisarts het vaakst of te vaak antibiotica voorschrijft: urineweginfecties, luchtweginfecties, bepaalde vormen van gastro-enteritis en huidinfecties. Tot slot wordt beschreven hoe door middel van DTO/FTO’s in Nederland wordt gewerkt aan het vergroten van kennis over antibioticumresistentie in de eerste lijn.
Summary
Most antibiotics in Dutch health care are prescribed by general practitioners. Therefore, the general practitioners play the key role to control antibiotic resistance. Studies in Europe show the most important factors to reduce antibiotic use. This article describes in which infectious diseases further progress still can be made. The current situation with regard to antibiotic resistance is elaborated on the clinical pictures where general practitioners often prescribe antibiotics: urinary tract infections, respiratory tract infections, certain types of gastroenteritis and skin infections. Finally, the role of DTO/FTOs is described to increase knowledge about antibiotic resistance in Netherlands.
Inleiding
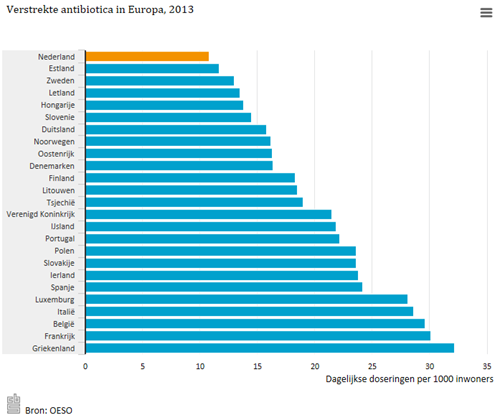
Ruim 80 procent van alle antibiotica die in de Nederlandse gezondheidszorg worden verstrekt, wordt voorgeschreven in de eerste lijn. Voor de meeste antibiotica die vaak door huisartsen worden voorgeschreven, wordt geen relevante toename in resistentie gezien.1 De belangrijkste oorzaak hiervoor is dat Nederland al sinds jaren de laagste voorschrijfcijfers voor antibiotica van Europa heeft (figuur 1).
Antibioticumstewardship (ABS) houdt zich bezig met het toespitsen op de juiste indicatie, het juiste middel en de juiste behandelduur en toedieningsweg van antibiotica. Programma’s voor ABS in de tweede lijn zijn redelijk succesvol. Implementatie van ABS in de eerste lijn leidt mogelijk tot een nog betere beheersing van antibioticumresistentie. Als deze aanpak in Nederland al effect zou sorteren, is het aannemelijk dat programma’s om rationeel antibioticumgebruik te bevorderen in de ons omringende landen, waar meer antibiotica worden voorgeschreven en meer resistentie voorkomt, nog effectiever kunnen zijn. Het is hierbij allereerst belangrijk om vast te stellen welke onderdelen van zo’n programma effectief zijn.
Een zoekopdracht in PubMed in april 2018 met als zoektermen ‘antimicrobial stewardship OR antibiotic stewardship AND general practioner OR general physician OR family doctor’ leverde 52 publicaties op. Alle publicaties zijn verschenen na 2012 en vaak niet specifiek gericht op huisartspraktijken. Opvallend genoeg komen de meeste publicaties uit Frankrijk, een land dat samen met Griekenland al jarenlang de hoogste voorschrijfcijfers van Europa laat zien (figuur 1).
Na de bespreking van de gepubliceerde buitenlandse studies zullen we ons in dit artikel richten op infecties die zich presenteren in de huisartsenpraktijk. Huisartsen schrijven voornamelijk antibiotica voor in het kader van urineweginfecties (UWI), luchtweginfecties (LWI) en huidinfecties. Hierbij bespreken we het huidige beleid en doen we suggesties voor ABS in de eerste lijn.
Buitenlandse studies en initiatieven
Buitenlandse studies laten zien dat verschillende omstandigheden en maatregelen belangrijk zijn bij ABS in Europa in de eerste lijn. Een Franse studie uit 2012 na de invoering van een behandelrichtlijn voor UWI toont een daling aan van voorschriften voor norfloxacine ten gunste van die voor nitrofurantoïne en fosfomycine.2 Een studie in Frankrijk voor gerichter gebruik van antibiotica bij huisartsen leidde tot de conclusie dat meer restricties moeten worden opgelegd bij het voorschrijven.3 Kwaliteitsindicatoren voor het gebruik van antibiotica waarbij gelet wordt op de substantiële variatie in het antibioticumvoorschrijfgedrag van Franse huisartsen, bieden een andere ingang voor verbetering.4 Verder bleek in Frankrijk dat laboratoria een belangrijke bijdrage kunnen leveren aan het verbeterprogramma, door het selectief rapporteren van gevoeligheid van verwekkers voor antibiotica.5 Daarnaast is het van belang meer aandacht te besteden aan juist antibioticumgebruik in de huisartsenopleiding evenals bij beginnende huisartsen in de eerste jaren van de beroepsuitoefing.6
Onderzoek in het Verenigd Koninkrijk voegt nog drie aspecten toe: het gebruik van point-of-care (POC) CRP-testresultaten, zoals beschreven in richtlijnen van de National Institute of Health and Care Excellence (NICE), reduceert de hoeveelheid antibioticumvoorschriften en is kosteneffectief.7 Een andere effectieve interventie om het ABS te ondersteunen, is het gebruik van ‘social norm feedback from a high-profile messenger’, waarvan in Nederland het geven van spiegelinformatie is afgeleid.8 Tot slot vond een Schotse studie dat sociale achterstand consistent geassocieerd was met een hoger voorschrijfniveau van antibiotica.9
Antibioticumresistentie werd tijdens het Nederlandse EU-voorzitterschap in Europa op de agenda gezet en krijgt jaarlijks aandacht op de European Antibiotic Awareness Day.10 Mogelijk ligt ook in Nederland de sleutel voor het in toom houden en liever nog terugdringen van antibioticumresistentie in de eerste lijn. Het is de vraag in hoeverre de relatief gunstige situatie in Nederland met betrekking tot rationeel antibioticumgebruik in de eerste lijn nog verder kan verbeteren. Is de in Frankrijk en het Verenigd Koninkrijk opgedane kennis hier bruikbaar? Bij welke infectieuze aandoeningen valt nog verdere reductie in antibioticumgebruik te behalen en hoe zouden ABS-programma’s ingezet kunnen worden? In de volgende paragrafen wordt de huidige situatie ten aanzien van antibioticumresistentie uitgewerkt voor de ziektebeelden waarbij de huisarts de meeste antibiotica voorschrijft.
Urineweginfecties
Resistentiedata uit urinekweken in de eerste lijn zijn beperkt beschikbaar. Wat beschikbaar is in diagnostische laboratoria, is afkomstig van ingestuurde kweken meestal na therapiefalen en is niet representatief voor de gehele populatie die de huisarts op zijn spreekuur krijgt. Gegevens over de ‘maagdelijke’ populatie zijn essentieel voor een optimale empirische keus. Hoewel de verwachting is dat laboratoriumgegevens een hoger resistentiepercentage laten zien, blijkt in de praktijk de resistentie tegen de twee eerstekeusmiddelen in de NHG-standaard erg mee te vallen. De belangrijkste verwekker van urineweginfecties in de huisartsenpraktijk is E. coli. Het resistentiepercentage in E. coli voor nitrofurantoïne en fosfomycine is in Nederland lager dan 2 procent. Daarom behoren deze middelen tot de eerste keus in de huidige NHG-standaard voor behandeling van UWI en kan dit voorlopig zo blijven. Hoewel er nu geen reden is tot zorg hierom, toont in-vitro-onderzoek aan dat resistentie gemakkelijk ontstaat. Daarom is monitoring van fosfomycine-resistentie van belang. 11
Nitrofurantoïne is het meest voorgeschreven antibioticum in de eerste lijn. Terughoudendheid in voorschrijven kan enerzijds bewerkstelligd worden door het niet direct voorschrijven van een antibioticum maar, zoals vaker in de eerste lijn gekozen wordt, het beloop even af te wachten. Een ‘uitgesteld’ recept zou eventueel mogelijk zijn, waarbij de patiënt wel al een recept meekrijgt maar met de instructie de kuur pas te starten als de klachten niet spontaan verbeteren. Zeker bij ouderen is terughoudendheid in het gebruik van nitrofurantoïne aan te raden. Bij ouderen worden relatief vaak Klebsiella- en Proteus-species in de urine gevonden, bacteriën die matig tot niet gevoelig voor nitrofurantoïne blijken te zijn. Bij oudere mensen, waarbij de helft van de vrouwen boven de 75 jaar regelmatig een bacteriurie heeft, is het ook nodig om een verschil te maken tussen bacteriurie en blaasontsteking, waarbij alleen in de laatste situatie antibiotica geïndiceerd zijn. Ook zou meer studie gedaan moeten worden naar de recidiverende urineweginfecties. Wellicht een belangrijk onderwerp voor een van de bestaande regionale zorgnetwerken?29
Luchtweginfecties
Bij luchtweginfecties is toename van resistentie geen groot probleem. Pneumokokken vertonen in Nederland nauwelijks resistentie voor penicilline. Gezien de geringe resistentie tegen penicillines zou men in Nederland vaker smalspectrumpenicillines moeten voorschrijven bij ongecompliceerde luchtweginfecties. Dus geen breedspectrum amoxicilline-clavulaanzuur (Augmentin®) maar smalspectrumpenicilline. Een huidig probleem bij het streven naar het gebruik van smalspectrumantibiotica is dat deze middelen regelmatig niet leverbaar zijn.
Een belangrijke verbetering is het verminderen van antibioticumgebruik. Een rapport over antibioticumgebruik bij luchtweginfecties in de eerste lijn toont dat huisartsen regelmatig antibiotica voorschrijven terwijl dat volgens de NHG-standaarden niet geïndiceerd is. Dit geldt vooral voor volwassenen met acute bronchitis/bronchiolitis, acute tonsillitis/peritonsillair abces, streptokokken-angina/roodvonk of acute/chronische sinusitis.12 Zoals eerder geformuleerd in de NHG-richtlijn luchtweginfecties: ‘Bij 20 tot 70 procent van patiënten is er geen indicatie voor antibiotica’.13 De richtlijn benadrukt het belang om rekening te houden met artsgebonden factoren (zoals diagnostische onzekerheid, tijdsdruk, vermeende verwachting van de patiënt en defensief handelen uit angst een ernstige ziekte niet te behandelen), die mogelijk bijdragen aan het onnodig voorschrijven van antibiotica. Het onderscheid tussen een virale en bacteriële LWI is van essentieel belang. Bij een matig zieke patiënt met het vermoeden van een pneumonie, kan de CRP-waarde doorslaggevend zijn in de besluitvorming wel of niet antibiotica voor te schrijven. Een lage CRP-waarde kan er, afhankelijk van de ziekteduur, op wijzen dat er geen ernstige infectie aanwezig is. Deze aanpak heeft een plaats gekregen in de NHG-standaard Acuut hoesten. Meer dan 95 procent van alle Nederlandse huisartsen gebruikt de CRP-sneltest. Mede afhankelijk van de waarde van het CRP overweegt de huisarts bij luchtweginfecties al of niet antibiotica voor te schrijven.14 Waar een Cochrane-review echter liet zien dat in het buitenland voorschrijven op basis van CRP-waarde leidde tot een reductie in het gebruik van antibiotica,15 toonde Nederlands onderzoek dat CRP-bepaling geen reductie in antibioticumvoorschriften tot gevolg had. Vermoedelijk komt dit doordat Nederlandse huisartsen al lage voorschrijfcijfers hadden.16 Een andere stap om onderscheid te maken tussen een virale of bacteriële infectie, zou gerichte aanvullende diagnostiek kunnen zijn; hierbij is het kostenaspect echter niet onbelangrijk.
Gastro-enteritis
Waar bij luchtweg- en urineweginfecties in de NHG standaarden een pleidooi wordt gehouden voor minder behandelen of afwachten met gebruik van antibiotica, geldt het “nee, tenzij...” voor de behandeling van een acute gastro-enteritis als uitgangspunt. Paradoxaal genoeg kunnen antibiotica als bijwerking gastro-enteritisklachten veroorzaken. Wel valt nog winst te boeken met het terugdringen van de behandeling van Dientamoeba fragilis. Vlak na het verschijnen van de NHG-standaard Acute diarree heeft Nederlands17,18 en Deens19 onderzoek duidelijk gemaakt dat Dientamoeba fragilis juist veel vaker voorkwam bij gezonde controles dan bij patiënten met gastro-enteritis. Hierdoor is het zeer onwaarschijnlijk is dat Dientamoeba veroorzaker van diarree is of dat een infectie met Dientamoeba fragilis behandeling behoeft.20 Toch merken wij tijdens diverse DTO’s dat nog lang niet alle huisartsen van ‘behandelen’ van D. fragilis met antibiotica afzien. Het zou goed zijn als dit soort onnodig gebruik van antibiotica achterwege wordt gelaten. Microbiologische laboratoria kunnen daarbij ondersteuning bieden door geen routinediagnostiek naar D. fragilis meer te uit te voeren, waardoor discussie over al dan niet behandelen niet meer hoeft plaats te vinden.20
Huidinfecties
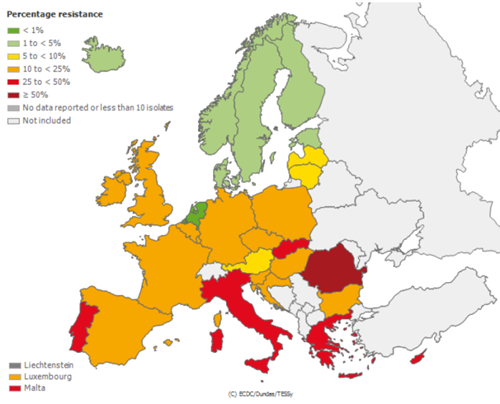
In 2017 verscheen de nieuwe NHG-standaard Bacteriële huidinfecties.21 Bij de totstandkoming van deze richtlijn kon worden uitgegaan van het feit dat S. aureus en S. pyogenes in Nederland nog amper resistentie vertonen tegen flucloxacilline. Dit in tegenstelling tot het voorkomen van MRSA in veel van ons omringende landen (figuur 2). In de richtlijn is gekozen voor een antibioticum met een zo smal mogelijk spectrum voor de behandeling van veelvoorkomende huidinfecties; dus geen breedspectrumantibiotica als amoxicilline-clavulaanzuur (Augmentin®) maar flucloxacilline bij behandeling van cellulitis en erysipelas. Wel vroegen de auteurs aandacht voor de geleidelijke toename van resistentie tegen clindamycine. In Nederland is het verstandig rekening te houden met de mogelijkheid van clindamycine-resistentie bij S. aureus, zeker wanneer er, zoals momenteel gebruikelijk is in de eerste lijn, geen kweek wordt uitgevoerd.
Prothese-infecties
Door de enorme toename van het aantal orthopedische operaties waarbij een prothese in een gewricht wordt geplaatst is ook het aantal prothese-infecties toegenomen. Het komt echter nog te vaak voor dat er bij patiënten die recent een prothese hebben gekregen en zich bij de huisarts melden met een beginnende infectie van de wond of de huid eromheen, direct begonnen wordt met antibiotica. Dit maakt diagnostiek naar de verwekker van de prothese-infectie ingewikkelder en soms onmogelijk, terwijl het resistentie tegen bepaalde orale antibiotica in de hand werkt. Deze orale antibiotica (bijvoorbeeld clindamycine) kunnen van cruciaal belang zijn voor langdurige behandeling van een prothese-infectie.
In de volgende paragrafen wordt beschreven welke acties er op dit moment al in Nederland worden ondernomen om antibioticumresistentie in de eerste lijn in te perken.
De rol van het RIVM
In 2015 heeft het ministerie van VWS het programma ‘Antibioticumresistentie’ gelanceerd. In een interview22 met programmaleiders Mariken van der Lubben en Arnold van Mourik staat hierover: “Daarnaast kan het voorschrijfbeleid van huisartsen en artsen in verpleeg- en ziekenhuizen worden verbeterd. Nederland is zuinig met voorschrijven, maar sommige artsen geven vaker antibiotica dan anderen. We willen graag weten waar dat aan ligt en het zou mooi zijn als we hun werkwijze uniformer kunnen maken.”
Het RIVM ontwikkelt sinds 2017 een landelijk programma ‘Juist gebruik; Surveillance & Stewardship antibioticumgebruik in de eerstelijns, tweedelijns en langdurige zorg’.23 Dit programma is onderdeel van door de minister geïnitieerde projecten om antibioticumresistentie beheersbaar te houden en daarmee zowel de algemene bevolking als de individuele patiënten optimaal te kunnen beschermen. Hierbij lijken de inspanningen zich vooral te richten op de verpleeg- en verzorgingshuizen, instellingen waar de meeste resistentie onder Enterobacteriaceae voorkomt. Bij huisartsen is een lokale ‘bottom up’ benadering via DTO/FTO’s op basis van hun eigen aanvraag- en voorschrijfgedrag (zie onder) echter veel effectiever dan een landelijke ‘top-down’ benadering .
Monitor Voorschrijfgedrag
De Monitor Voorschrijfgedrag Huisartsen (MVH) verschijnt jaarlijks, in 2017 al voor de twaalfde keer. De monitor brengt het landelijke voorschrijfgedrag van huisartsen in kaart. Voorschrijfindicatoren zijn relevant voor het stimuleren van de kwaliteit en doelmatigheid van het voorschrijven. De laatste keer dat antibiotica werden besproken was in 2016, in hoofdstuk 3 van de monitor.24
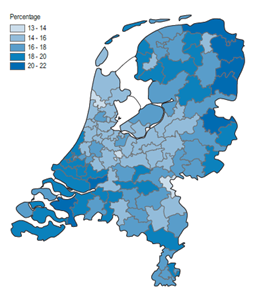
Tussen huisartsen onderling bestaan grote verschillen in het voorschrijfvolume van antibiotica. De spreiding in het percentage patiënten dat in 2015 minimaal één antibioticum ontving, varieert van 12 tot 23 procent. De meest voorschrijvende huisartsen schrijven dus bijna twee keer zo veel antibiotica voor als de minst voorschrijvende huisartsen. En naast grote verschillen tussen huisartsen, bestaan er grote regionale verschillen. Figuur 3 geeft per regio het aantal inwoners weer dat een antibioticum gebruikt. In Groningen, Drenthe, Zuid-Holland en Zeeland worden relatief veel antibiotica voorgeschreven door huisartsen.
Het verschijnen van dergelijke landkaartjes in een MVH leidt steevast tot aandacht in de lokale lekenpers. Hierbij is het echter maar de vraag of de individuele huisartsen veel te verwijten valt, aangezien de demografie van een studentenstad als Nijmegen nogal afwijkt van die van uitschieters als Oude Pekela. In de laatste praktijken wordt een veelvoud aan oudere, rokende en/of tot een risicogroep behorende patiënten gezien van wie bekend is dat zij vaker een pneumonie hebben. Huisartsen uit die plaats hebben dat ook uitgelegd in de lokale pers. Bij dergelijke indicatorscores in een MVH komt veel nadruk op huisartsen die 50 procent meer voorschrijven dan collega’s. Er is verder weinig aandacht voor het te weinig voorschrijven van antibiotica, hetgeen bijvoorbeeld bij acute middenoorontsteking wel degelijk tot complicaties kan leiden. Een betere vorm van feedback dan deze MVH is het op HAGRO-niveau spiegelen van elkaars voorschrijfgedrag door middel van een FTO.
Wat is een DTO-FTO?
Het Farmacotherapie overleg (FTO) en het Diagnostisch Toets Overleg (DTO) zijn regionale, periodieke overlegvormen van huisartsengroepen. DTO en FTO zijn instrumenten om het rationeel en doelmatig aanvragen van eerstelijnsdiagnostiek en voorschrijven van antibiotica te bevorderen (zinnige en zuinige zorg). Recent is een door de NVMM en het NHG onderschreven handleiding voor deze DTO’s gepubliceerd.25 In de richtlijn DTO wordt de kracht van spiegelinformatie benadrukt, zeker wanneer de mogelijke verschillen in een veilige omgeving van een vaste huisartsengroep (HAGRO) met elkaar besproken kunnen worden.25 Bij een aantal microbiologische onderwerpen verdient het aanbeveling in het kader van goed antibioticumgebruik het DTO te combineren met het FTO. Aanbieders van diagnostiek en huisartsen in de regio werken samen bij het organiseren van een DTO. Hieraan nemen 10-15 huisartsen, huisartsen in opleiding, coassistenten en, voor het FTO, apothekers van een praktijkgebied deel. Het optimale aantal huisartsen per DTO is 6 tot 12. Bij minder huisartsen is geen efficiënte organisatie van het DTO mogelijk en kan er te weinig discussie plaatsvinden. Een grotere groep kan leiden tot passiviteit bij de deelnemers, waardoor het DTO minder effectief is.25
Tijdens de bijeenkomsten worden farmacotherapeutische thema’s besproken, vaak gebaseerd op nieuwe of recent herziene richtlijnen. Eimers et al. onderzochten of de kwaliteit van voorschrijven van huisartsen samenhangt met de kwaliteit van het FTO waaraan deze huisartsen deelnemen. Hieruit blijkt dat een goed FTO positief bijdraagt aan de kwaliteit van voorschrijven en meer antibiotica van eerste keus werden voorgeschreven.26 Recenter onderzoek uit 2016 toont dat het voorschrijfgedrag van antibiotica te beïnvloeden is door interventies tijdens het FTO.27 Het organiseren van DTO’s wordt sinds een aantal jaren gecontracteerd als onderdeel van de zorg die door aanbieders van diagnostiek geleverd moet worden en is onderdeel van de overeenkomst tussen huisartsen en zorgverzekeraars. Voor huisartsen leidt dit wel tot een verdere toename van het reeds overstelpende scholingsaanbod. Omdat DTO/FTO’s als nascholing effectiever en motiverender werken, zijn de huisartsen en zorgverzekeraars dit desondanks overeengekomen. Randvoorwaarden die zorgverzekeraars stellen aan DTO/FTO zijn:28
- een periodieke intervisiebijeenkomst van bijvoorbeeld een HAGRO en inhoudsdeskundige(n) van eerstelijnsdiagnostiek;
- de huisarts heeft minimaal 100 keer eerstelijnsdiagnostiek aangevraagd bij het laboratorium dat het DTO organiseert;
- het aantal deelnemers is dusdanig dat intervisie op individueel niveau mogelijk is;
- deelnemers zijn fysiek aanwezig;
- gerichte scholing en kennisoverdracht over aanvraagbeleid en voorschrijfgedrag;
- bespreking van spiegelinformatie en een verbetercyclus om aanvraaggedrag te verbeteren.
Voor deelname aan het DTO ontvangt de huisarts een honorering van rond 0,50 euro per verzekerde per jaar en accreditatiepunten die nodig zijn voor herregistratie. De voorbereiding van presentaties, data-extractie en uitvoering van een DTO kosten veel tijd. Onderhoud van logistieke informatie met waarborgen voor de onafhankelijkheid van het DTO en de anonimisering van de data en voldoende meerjarige financiële middelen voor het verzorgen van DTO/FTO’s voor vakspecialisten van laboratoria vormen een essentiële randvoorwaarde.
Een programma ter bevordering van rationeel antibioticumgebruik in de eerste lijn zou in Nederland vorm kunnen krijgen door te investeren in de bestaande DTO/FTO’s. Hieronder wordt beschreven welke leerdoelen van belang zijn.
Leerdoelen in een DTO-FTO antibioticumresistentie
Het FTO antibioticumresistentie bestaat uit een inleiding over het ontstaan van resistentie. Nadruk ligt op het feit dat onze huis-, tuin- en keukenbacteriën E. coli en S. aureus gevaarlijk resistent worden terwijl er geen nieuwe antibiotica op komst zijn. Het is dé bedreiging voor de gezondheidszorg in Nederland. Tijdens FTO’s over antibioticumresistentie worden maatregelen ter preventie van de verspreiding van resistentie op een rij gezet:
- op basis van door regionale apothekers verstrekte gegevens wordt gereflecteerd op eigen voorschrijfcijfers en worden mogelijk te nemen maatregelen besproken;
- regionale clusters van resistente bacteriën kunnen door lokale artsen-microbioloog alleen goed gesignaleerd worden indien de diagnostiek op een lokaal eerstelijnslaboratorium uitgevoerd wordt. Wegvloeien van diagnostiek naar laboratoria die niet regionaal werken heeft als ongewenst gevolg het verdwijnen van een goed overzicht van resistentie;
- onterecht voorschrijven van antibiotica leidt tot onnodige toename van resistentie. Meer tijd nemen voor een patiënt tijdens een consult kan voorkomen dat die met een recept voor antibiotica de deur uitgaat met minder kans op resistentieontwikkeling;
- gekeken wordt of voorschrijfgedrag tijdens diensten op huisartsenposten verschilt van voorschrijfgedrag (vaak door dezelfde huisarts) in de eigen praktijk.
Resistentiegegevens worden teruggekoppeld op basis van resistentiecijfers van eigen kweken van de deelnemende huisartsen. Vergelijking met regionale en landelijk cijfers wordt gepresenteerd. Verder worden de apothekers van de FTO-groepen benaderd over de ‘top 6’ van voorschrijfcijfers van de deelnemende huisartsen in de afgelopen twee tot drie jaar.
Het is belangrijk dat het DTO plaatsvindt in een vaste groep, omdat elkaar (leren) kennen en een veilig klimaat nodig zijn voor een optimaal functioneren van de DTO/FTO-groep. Externe partijen kunnen hierbij afbreuk doen aan de voorwaarden van veiligheid en vertrouwelijkheid. Dit geldt zelfs voor praktijkondersteuners en waarnemers.25 Interactie tussen deelnemers op basis van spiegelinformatie en expertise op het gebied van diagnostisch onderzoek en antibiotische therapie zijn onmisbare elementen van een effectief DTO/FTO.25 Het denken en werken in zorgnetwerken moet er niet toe leiden dat spiegelinformatie over laboratoriumuitslagen door andere partijen ter beschikking wordt gesteld dan door het laboratorium dat de diagnostiek en de resistentiebepalingen verricht in de regio waar de zorg geleverd wordt.
Het ministerie van VWS heeft dan ook in de criteria voor het aanvragen van projectsubsidies in het kader van zorgnetwerken vastgelegd dat gewaakt moet worden voor substitutie van bestaande activiteiten. De activiteiten mogen niet vallen onder de eigen verantwoordelijkheid van de zorgaanbieder en er moet vermeden worden dat de activiteiten overlappen met andere, al bestaande activiteiten. Het is bijvoorbeeld niet zinvol als teams infectieziektebestrijding van de GGD bestaande FTO/DTO’s overnemen van de sleutelspelers in de regio op het gebied van diagnostiek en resistentiebepaling, om antibioticumresistentie in de regio tegen te gaan. Bestaande FTO/DTO’s worden dan immers doorkruist. DTO werkt als interactieve vorm van nascholing aantoonbaar effectiever en motiverender dan klassikale nascholing en het nascholingsaanbod aan huisartsen is al overstelpend.25
Door het aanbieden en organiseren van periodieke DTO-FTO’s aan huisartsengroepen kunnen de eigen diagnosticerende laboratoria eenvoudig de regie behouden en ABS in de eerste lijn invullen. De vergoeding voor het verzorgen van DTO-FTO’s moet beter geregeld worden door de zorgverzekeraars, die de organisatie ervan verplicht stellen. Concluderend zijn in Nederland met name de huisartsen op de goede weg als het gaat om rationeel en terughoudend antibioticumgebruik. Om de terughoudendheid in antibiotica te bevorderen heeft het toenmalige ministerie van VWS gepleit voor een 50 procent reductie van antibioticumgebruik in eerste lijn. Na onderhandeling met de LHV is overeengekomen dat het veld streeft naar 50 procent reductie van overbodig antibioticumgebruik. Voor de Nederlandse artsen-microbioloog (NVMM) is het duidelijk dat we niet zullen rusten alvorens een 100 procent reductie van overbodig antibioticumgebruik in Nederland is bereikt.