Virale resistentie
Antivirale medicijnen zijn veelal gericht op virale enzymen die een rol hebben in de replicatiecyclus van het virus. Resistentie ontstaat meestal door selectie van mutaties in de genen die coderen voor deze enzymen. Met name RNA-virussen hebben een relatief hoge mutatie- en replicatiesnelheid, wat leidt tot een heterogene virale populatie, quasispecies genoemd. Binnen deze quasispecies is er continue sprake van selectie en evolutie. Selectie van virusvarianten met resistentiemutaties treedt vooral op indien er virale replicatie plaatsvindt onder selectieve druk van medicijnen, bijvoorbeeld wanneer spiegels te laag zijn door onvoldoende therapietrouw, interacties of verminderde absorptie. Door genotypische sequentieanalyse kan op basis van de aangetoonde mutaties de gevoeligheid van het virus voor de verschillende antivirale medicijnen worden voorspeld.
Antwoord vraag 1: C
Toelichting
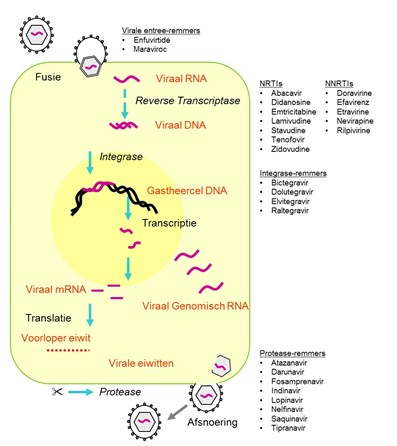
Er zijn diverse klassen hivremmers beschikbaar die aangrijpen op verschillende stappen in de virale cyclus (figuur 1). NRTI’s (nucleoside reverse transcriptase inhibitors) zijn als het ware valse bouwstenen voor het virus waardoor de omzetting van RNA naar DNA door reverse transcriptase (RT) wordt geremd. NNRTI’s (non-NRTI), integraseremmers en proteaseremmers binden respectievelijk aan RT, integrase en protease, waardoor de functie van deze virale enzymen wordt geremd. Daarnaast zijn er hivremmers die virale entree remmen, bijvoorbeeld door blokkering van de CCR5 co-receptor.
Het RT van hiv is foutgevoelig en genereert random mutaties bij de omzetting van RNA naar DNA, wat in combinatie met de hoge replicatiesnelheid leidt tot een grote diverse virale populatie. Voor het volledig onderdrukken van de virale replicatie is een combinatie van remmers nodig. Omdat resistente varianten ook kunnen worden overgedragen naar een nieuw individu, adviseren richtlijnen om bij elke nieuwe hiv-patiënt een genotypische sequentieanalyse te verrichten, om informatie te verkrijgen over het baseline resistentieprofiel. Indien er sprake is van resistentie zal dit meegewogen worden bij de keuze van de therapie.
Bij deze casus zijn diverse mutaties in het RT-gen aangetoond. Belangrijke NRTI-resistentiemutaties zijn thymidine-analoog mutaties (TAM’s, waaronder M41L, D67N, K70R, L210W, T215Y/F, K219Q/E), M184V (hoge mate van resistentie tegen lamivudine en emtricitabine) en K65R (resistentie tegen alle NRTI’s met uitzondering van zidovudine). De aanwezigheid van meerdere TAM’s geeft verminderde gevoeligheid voor de meeste NRTI’s (abacavir, didanosine, stavudine, tenofovir en zidovudine) door excisie van de NRTI aan het uiteinde van het DNA. De meest voorkomende NNRTI-resistentiemutaties zijn K103N en Y181C. K103N resulteert in hoge mate van resistentie tegen nevirapine en efavirenz; Y181C resulteert in vitro in uitgebreide resistentie tegen nevirapine, maar op basis van klinische data zijn er ook aanwijzingen voor een verminderde respons tegen efavirenz, rilpivirine en etravirine.
Antwoord A, B en D bevatten alle drie NRTI’s, waarbij de regimes in antwoord B en D naast de NRTI’s een derde medicijn bevatten (respectievelijk NNRTI rilpivirine en integraseremmer elvitegravir) met een lage genetische barrière voor resistentie (met andere woorden, het virus kan gemakkelijk resistentie selecteren en heeft weinig mutaties nodig om resistent te worden). Met de reeds bestaande resistentie tegen NRTI’s is de verwachte activiteit van deze regimes onvoldoende.
Optie C bevat geen NRTI’s, maar bestaat uit een proteaseremmer (geboost door cobicistat) en een integraseremmer. Bij deze casus is geen resistentie aangetoond in integrase of protease. Beide medicijnen hebben een hoge genetische barrière voor resistentie. Een dergelijke combinatie is een goede keuze in het geval van uitgebreide resistentie tegen NRTI’s en NNRTI’s, zoals in deze casus.
Bron: Wensing AMJ et al. 2017 Update of the Drug Resistance Mutations in HIV-1. Top Antivir Med. 2017;24:132-3.
Antwoord vraag 2: A
Toelichting
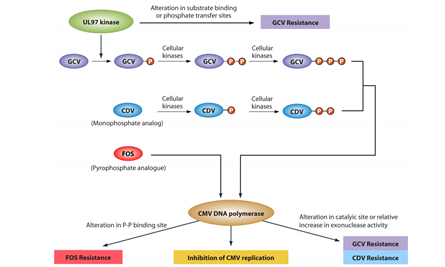
Een belangrijk enzym in de replicatiecyclus van CMV is het DNA-polymerase, waar de verschillende CMV-medicijnen op aangrijpen (zie figuur 2). Vergeleken met het RT van hiv, is het DNA-polymerase van CMV minder foutgevoelig. Resistentie bij CMV treedt minder snel op dan bij hiv. Voor de behandeling van CMV is slechts een beperkt aantal medicijnen beschikbaar, maar meestal is therapie met één medicijn voldoende om de virale replicatie te onderdrukken .
De meest toegepaste therapie is (val)ganciclovir. Ganciclovir is een nucleoside-analoog, die als deoxyguanosine-trifosfaatanaloog het DNA-polymerase remt en daarmee de virale DNA-synthese. Voordat het medicijn zijn werking kan uitoefenen moet ganciclovir eerst drie fosforylatiestappen ondergaan, waarvan de eerste door het virale UL97-kinase wordt gefaciliteerd en de andere door cellulaire kinasen.
Bij (verwachte) toxiciteit of therapiefalen kan ook gekozen worden voor foscarnet of (brin)cidofovir. Foscarnet is een pyrofosfaatanaloog die de pyrofosfaatbindingsplaats blokkeert en hiermee het DNA-polymerase remt. Activiteit van foscarnet is niet afhankelijk van fosforylering. Cidofovir heeft al één fosfaatgroep en gebruikt voor fosforylering alleen cellulaire kinasen. Brincidofovir is een lipidenconjugaat van cidofovir, en legt daarmee intracellulair dezelfde route af als cidofovir.
Omdat alleen ganciclovir afhankelijk is van het virale UL97-kinase, geven mutaties in UL97 alleen resistentie tegen (val)ganciclovir. Mutaties in het UL54 dat codeert voor het DNA-polymerase kunnen resistentie tegen een of meer van deze medicijnen geven, afhankelijk van de aangetoonde mutaties.
Het nieuwste middel, letermovir, dat recent geregistreerd is voor profylaxe van CMV-reactivatie bij hematologische patiënten na een allogene stamceltransplantatie, heeft een ander werkingsmechanisme dan de hierboven beschreven remmers, en remt het CMV-DNA-terminasecomplex. De eerste in vitro- en in vivostudies laten met name resistentie zien door mutaties in UL56, die geen kruisresistentie lijkt te geven met de andere remmers.
Bronnen:
- Lurain NS, Chou S. Antiviral Drug Resistance of Human Cytomegalovirus. Clinical Microbiology Reviews. 2010;23:689-712.
- Piret J, Boivin G. Clinical development of letermovir and maribavir: Overview of human cytomegalovirus drug resistance. Antiviral Res. 2019;163:91-105.