Samenvatting
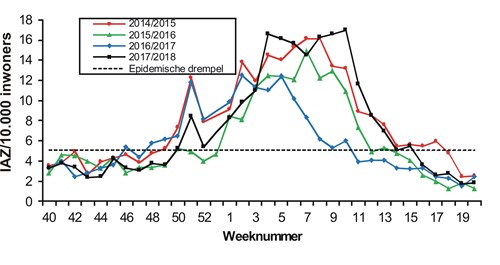
De influenza-epidemie van het seizoen 2017/2018 begon in week 50 van 2017 en duurde 18 weken. De epidemie piekte in week 10 van 2018 met een incidentie van 17 personen met influenza-achtige ziektebeelden per 10.000 inwoners, en een incidentie vlakbij dit maximum van week 4 tot en met 9. De meeste influenza-activiteit werd veroorzaakt door influenza B-virussen van de Yamagatalijn, terwijl een influenza B-virus van de Victorialijn in het vaccin was opgenomen. Richting het einde van het seizoen werden er geleidelijk meer influenza A-virussen gedetecteerd. De A(H1N1)pdm09-virussen behoorden tot clade 6b.1 en vertoonden goede antigene gelijkenis met de vaccinstam. De A(H3N2)-virussen behoorden hoofdzakelijk tot clades 3C.2a2 en 3C.2a1b, waarvoor de antigene overeenkomst met de vaccinstam redelijk tot goed was. Sporadisch werden ook influenza B-virussen van de Victorialijn gedetecteerd die een deletie in het hemagglutinine hadden en antigeen sterk afweken van de vaccinstam. Bijzonder was de detectie van een reassortant A(H1N2)-virus dat slechts bij één patiënt gevonden werd. De vaccineffectiviteit tegen bevestigde influenza B/Yamagata-virusinfectie was circa 44 procent.
Van de 744 virussen die zijn getest op gevoeligheid voor neuraminidaseremmers bleek één A(H1N1)pdm09-virus een sterk verlaagde gevoeligheid voor oseltamivir te hebben. Virussen van beide circulerende influenza A-virussubtypen zijn in de regel resistent tegen M2-ionkanaalblokkers.
Voor het seizoen 2018/2019 heeft de WHO voor het noordelijk halfrond de volgende vaccinsamenstelling aanbevolen voor trivalente vaccins:
- voor A(H1N1)pdm09 een A/Michigan/45/2015-achtig virus;
- voor A(H3N2) een A/Singapore/INFIMH-16-0019/2016-achtig virus;
- voor B een B/Colorado/06/2017-achtig virus van de Victorialijn.
Abstract
The influenza epidemic of 2017/2018 started in week 50 of 2017 and lasted 18 weeks. The epidemic had a peak incidence in week 10 of 2018 of 17 persons with influenza-like illness (ILI) per 10.000 inhabitants and ILI incidence near this maximum from weak 4 until week 9. Influenza B-viruses of the Yamagata lineage were responsible for most influenza activity in a season with an influenza B-virus of the Victoria lineage included in the vaccine. Influenza A-viruses were detected with increasing frequency towards the end of the season. The A(H1N1)pdm09-viruses belonged to clade 6b.1 and displayed good antigenic similarity to the vaccine strain. The A(H3N2)-viruses mostly belonged to clades 3C.2a2 and 3C.2a1b, for which the antigenic similarity to the vaccine strain was fair to good. Influenza B-viruses of the Victoria lineage that were antigenically divergent from the vaccine due to a deletion in the hemagglutinin gene were detected sporadically. Noteworthy was the detection of a seasonal reassortant A(H1N2) virus in a single patient.
Griep
Griep kan bij mensen veroorzaakt worden door influenzavirussen van het type A, B of C, waarvan de laatste in de regel het minst ernstige ziektebeeld veroorzaakt.1 Momenteel circuleren er wereldwijd bij mensen twee subtypen van het influenzavirus type A – te weten A(H1N1)pdm09 en A(H3N2) – en twee genetische lijnen van influenzavirus type B die ook qua antigene eigenschappen verschillen, namelijk de Yamagatalijn en Victorialijn.2 In het kader van het Nationaal Programma Grieppreventie worden mensen met een medische indicatie en mensen van 60 jaar en ouder jaarlijks in oktober of november uitgenodigd om gevaccineerd te worden tegen de griep. In Nederland wordt gevaccineerd met een trivalent griepvaccin dat, op basis van aanbeveling door de Wereldgezondheidsorganisatie (WHO), componenten bevat van influenzavirus A(H1N1)pdm09 en A(H3N2) en een van de twee influenzavirustype B-lijnen.3 Deze aanbeveling voor de vaccinsamenstelling is gebaseerd op epidemiologische en virologische gegevens die tot ongeveer zes maanden voor de vaccinatiecampagne wereldwijd worden verzameld. Er is namelijk ongeveer een half jaar nodig om voldoende vaccin te produceren.4
Influenzasurveillance
Al snel na de introductie van griepvaccins werd duidelijk dat voor een goede vaccingeïnduceerde bescherming een goede antigene verwantschap nodig is tussen het vaccin en de circulerende influenzavirussen. De WHO coördineert al jarenlang een wereldwijd influenzasurveillance- en responssysteem (GISRS) dat veranderingen in influenzavirussen in kaart brengt in relatie tot ziekte.5
Het Nivel, Nederlands instituut voor onderzoek van de gezondheidszorg, registreert wekelijks het aantal patiënten dat zich met een influenza-achtig ziektebeeld (IAZ) meldt bij de huisarts. Ook wordt in Nederland het aantal patiënten geregistreerd dat een acute respiratoire infectie (ARI) anders dan IAZ heeft. Van virussen die worden gedetecteerd in de luchtwegmonsters van huisarts- en ziekenhuispatiënten worden de antigene eigenschappen gekarakteriseerd en wordt de gevoeligheid voor antivirale middelen vastgesteld. Ook wordt van een deel van de influenzavirussen de genoomsequentie bepaald om genetische veranderingen en evolutie van de circulerende virussen te monitoren. Het Nationaal Influenza Centrum rapporteert wekelijks de gegevens over de epidemie in Nederland aan het European Centre for Disease Prevention and Control (ECDC) en de WHO. Bovendien wordt een selectie van de Nederlandse influenzavirusisolaten jaarlijks opgestuurd naar het WHO Collaborating Centre in London. Daar wordt aanvullend onderzoek gedaan om de Europese antigene karakteriseringsdata te integreren in het wereldwijde overzicht voor de aanbevelingen voor het influenzavaccin voor het komende seizoen.
Resultaten en discussie
De influenza-epidemie van het seizoen 2017/2018
De influenza-epidemie van 2017/2018 duurde in totaal 18 weken, van 11 december 2017 (week 50) tot en met 15 april 2018 (week 15). In Nederland spreken we van een epidemie wanneer in twee opeenvolgende weken meer dan 5,1 op de 10.000 mensen zich bij hun huisarts melden met IAZ en er tegelijkertijd in de neus- en keelmonsters van een deel van deze patiënten influenzavirus wordt aangetoond. De epidemie van 2017/2018 was twee keer zo lang als gemiddeld en slechts iets korter dan het langst geregistreerde seizoen 2014/2015, dat 21 weken duurde.6,7 De piek van de epidemie was ongebruikelijk breed en hoog, met een maximum van 17.0 IAZ per 10.000 populatie in week 10 en een IAZ-incidentie vlakbij dit maximum gedurende zes opeenvolgende weken voorafgaand aan deze piek (zie figuur 1). In de maand maart werden tevens veel ouderen met een longontsteking gezien, voor wie soms ziekenhuisopname noodzakelijk was.8 Naar schatting hebben circa 900.000 mensen in 2017/2018 griep gehad en zijn er tijdens deze epidemie circa 9500 meer mensen overleden dan normaal, van wie een deel aan de gevolgen van griep.9
Overzicht van de onderzochte influenzavirussen
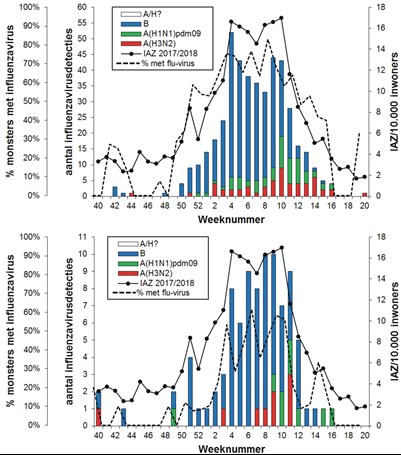
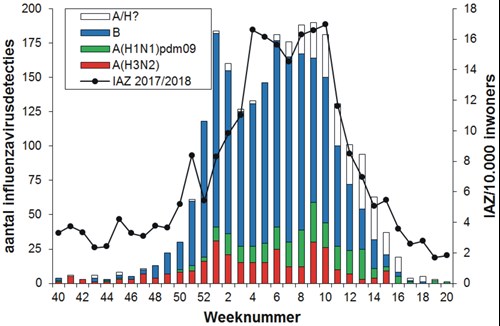
De griepepidemie van 2017/2018 werd vooral veroorzaakt door influenzavirustype B van de Yamagatalijn. In de 452 influenzavirus-positieve monsters afgenomen door peilstationhuisartsen bij IAZ-patiënten werd 330 keer (73 procent) een influenzavirustype B van de Yamagatalijn gevonden, vier keer (1 procent) een influenzavirustype B van de Victorialijn, 56 keer (12 procent) een A(H3N2)-virus en 61 keer (13 procent) een A(H1N1)pdm09-virus. Daarnaast werd in deze collectie eenmaal een reassortant van seizoensinfluenzavirussen aangetroffen, namelijk een influenza A(H1N2)-virus.10 Bij de influenzavirus-positieve monsters van 92 ARI-patiënten werd 73 keer (79 procent) een influenzavirustype B van de Yamagatalijn gevonden, één keer (1 procent) een influenzavirustype B van de Victorialijn, negen keer (10 procent) een A(H3N2)-virus en negen keer (10 procent) een A(H1N1)pdm09-virus (zie tabel 1 en figuur 2). Van de 2414 door diagnostische ziekenhuislaboratoria aangemelde influenzavirussen waren er 1577 (65 procent) van het B-type en 837 (35 procent) van het A-type. Van de verder gekarakteriseerde A-virussen waren er 303 van het A(H3N2)-subtype en 258 van het subtype A(H1N1)pdm09. Van de verder gekarakteriseerde B-virussen behoorden er 966 tot de Yamagatalijn en negen tot de Victorialijn (zie tabel 1 en figuur 3).
Karakterisering van influenza B-virussen van de Yamagatalijn
Het overgrote deel van de dit seizoen in Nederland circulerende virussen behoorde tot de Yamagatalijn van influenzavirus type B. Deze virussen vielen allemaal in genetische clade 3, waartoe ook de vaccinstam van de Yamagatalijn (B/Phuket/3073/2013) behoort. Tussen de Nederlandse virussen van de Yamagatalijn onderling werd relatief weinig antigene variatie waargenomen met frettensera in de hemagglutinatieremmingtest (HAR, zie tabel 2). Wel werd in deze virussen enige antigene drift waargenomen over de laatste seizoenen. De reactiviteit van de 2017/2018-virussen met sera die opgewekt zijn tegen de vaccinstam B/Phuket/3073/2013 komen echter volgens het WHO-netwerk nog net voldoende overeen met de reactiviteit van de vaccinstam zelf om deze component van het vaccin nog niet aan te passen.
Karakterisering van influenza B-virussen van de Victorialijn
Er werd in het seizoen 2017/2018 slechts een beperkt aantal influenzavirussen type B van de Victorialijn gedetecteerd in Nederland. Deze virussen behoorden tot genetische clade 1A, waartoe ook de vaccinstam B/Brisbane/60/2008 behoort. Ten opzichte van de vaccinstam en de virussen van de afgelopen jaren vertoonden deze virussen van de Victorialijn echter een deletie van twee aminozuren (K162, N163) in het HA-eiwit. Wereldwijd is een toename van de circulatie van deze virussen gedetecteerd. De antigene eigenschappen van deze virussen zijn duidelijk verschillend van die van B/Brisbane/60/2008, maar komen overeen met die van de nieuwe vaccinreferentiestam B/Colorado/6/2017, die door het WHO-netwerk als update werd aanbevolen (zie tabel 3).
Karakterisering van influenza A(H1N1)pdm09-virussen
A(H1N1)pdm09-virussen werden in toenemende mate gedetecteerd aan het einde van de 2017/2018-epidemie. Alle A(H1N1)pdm09-virussen van dit seizoen behoorden genetisch tot clade 6B.1. Sinds de pandemie van 2009 hebben de A(H1N1)pdm09-virussen nog weinig antigene variatie laten zien in analyses met frettensera (zie tabel 4). Echter, op basis van humane serologie is voor de vaccinatie voor het seizoen 2017/2018 besloten tot een update van deze vaccincomponent. De Nederlandse A(H1N1)pdm09-virussen van het afgelopen seizoen vertoonden goede antigene overeenkomst met de oude en nieuwe vaccinreferentiestammen in de HAR-test met frettensera (zie tabel 4).
Karakterisering van influenza A(H3N2)-virussen
Net als de A(H1N1)pdm09-virussen werden influenza A(H3N2)-virussen vooral aan het einde van de 2017/2018-epidemie gedetecteerd. De antigene karakterisering van deze A(H3N2)-virussen is nog altijd problematisch omdat de virussen niet of nauwelijks in staat zijn rode bloedcellen te agglutineren. Wanneer agglutinatie toch wordt waargenomen, is dit vaak het resultaat van een mutatie in het NA-gen, waardoor de agglutinatie via het NA-eiwit kan verlopen.11,12 Hierdoor kan de HAR-test voor de karakterisering van HA niet of nauwelijks worden gebruikt, en moet gewerkt worden met een minder reproduceerbare en meer bewerkelijke virusneutralisatie (VN-) test.12-14
De antigene eigenschappen van de A(H3N2)-virussen van 2017/2018 waren, evenals vorig seizoen, heterogeen (zie tabel 5). Zo lieten frettenantisera opgewekt tegen twee recente A(H3N2)-virussen goede homologe neutralisatie zien, maar slechte kruisneutralisatie. Frettensera opgewekt tegen de op eieren geproduceerde A(H3N2)-vaccinstammen voor 2017/2018 (X263B; A/Hongkong/4801/2014) en 2018/2019 (NIB104; A/Singapore/INFIMH-16-0019/2016) gaven in de regel lage kruisreactiviteit tegen de Nederlandse epidemische stammen. Dit probleem is te wijten aan het feit dat de antigene eigenschappen van recente A(H3N2)-vaccinstammen veranderen na herhaalde passage in eieren terwijl die eipassage nodig is voor vaccinproductie, nog afgezien van de antigene heterogeniteit van de circulerende virussen.
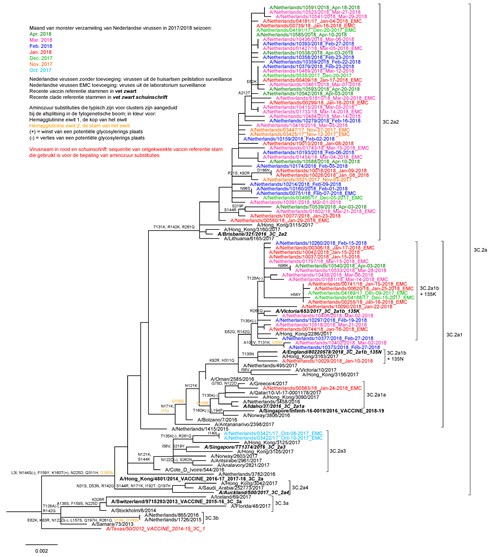
Door de moeizame antigene karakterisering van A(H3N2)-virussen speelt de genetische karakterisering van deze virussen een steeds grotere rol bij de besluitvorming rond de vaccinsamenstelling. Genetische analyse van HA van de in Nederland circulerende A(H3N2)-virussen bevestigde de antigene diversiteit (zie figuur 4). In Nederland circuleerden in het afgelopen seizoen virussen die vooral behoorden tot clade 3C.2a1b en 3C.2a2; er werden ook enkele virussen gedetecteerd die behoorden tot 3C.2a3 en 3C.2a1. In clades 3C.2a1b en 3C.2a2 ontstond nieuwe genetische diversiteit met mogelijk implicaties voor antigene eigenschappen.
De keuze voor de clade 3C.2a1-vaccinstam A/Singapore/INFIMH-16-0019/2016 ter vervanging van de clade 3C.2a-vaccinstam A/Hongkong/4801/2014 lijkt vooral gebaseerd te zijn op de lage frequentie van detectie van clade 3C.2a3-virussen en de mogelijk iets betere reactiviteit van circulerende 3C.2a1b- en 3C.2a2-virussen met sera opgewekt tegen eigekweekt A/Singapore/INFMH-16-0019/2016. Momenteel is het echter vrijwel onmogelijk om een gedegen keuze te maken voor een A(H3N2)-vaccincomponent, door de cocirculatie van diverse antigene varianten en de antigene instabiliteit van deze varianten in eieren. Hierdoor is voor het zuidelijk halfrond inmiddels weer een nieuw eigekweekt virus (A/Switzerland/8060/2017) gekozen, terwijl voor celgekweekte vaccins nog altijd A/Singapore/INFMH-16-0019/2016 werd aanbevolen.
Een patiënt met A(H1N2)-virusinfectie
Op 5 maart 2018 werd een Nederlandse huisartsenpraktijk bezocht door een kindje van 19 maanden dat sinds drie dagen last had van koorts, malaise, zere keel, hoesten, kortademigheid, loopneus en diarree. Na een tweede bezoek aan de huisarts op 8 maart voor een middenoorontsteking werd een behandeling gestart met antibiotica (40 mg/kg amoxicilline driemaal daags gedurende zeven dagen) en herstelde de patiënt binnen enkele dagen volledig. In een neus- en keelmonster van de patiënt werd met reversetranscriptase-polymerasekettingreactie (RT-PCR) een A(H1N2)-influenzavirus gedetecteerd, wat bevestigd kon worden door sequentie-analyse van het complete virale genoom. Het nieuwe griepvirus bleek een seizoensreassortant griepvirus te zijn met de HA- en NS-genen van een recent humaan A(H1N1)pdm09-virus en de overige zes gensegmenten van een recent humaan A(H3N2)-virus. Om eventuele verspreiding in kaart te brengen werden GGD’en, laboratoria en internationale organisaties geïnformeerd over deze vondst, maar er werden geen andere besmettingen met dit griepvirus gevonden. Op basis van de HA- en NA-sequenties werd geconcludeerd dat de griepprik van dit seizoen waarschijnlijk ook bescherming gaf tegen deze variant en dat het virus gevoelig moet zijn geweest voor neuraminidaseremmers oseltamivir en zanamivir.10
Vaccineffectiviteit
De vaccineffectiviteit tegen in het laboratorium bevestigde infecties met influenzavirus type B van de Yamagatalijn in Nederland was ongeveer 44 procent. In de leeftijdsgroep onder de 60 jaar was dit ongeveer 39 procent en in mensen boven de 65 was dit ongeveer 56 procent.9 Interimresultaten van het Europese I-Move-netwerk waar Nederland aan deelneemt lieten over alle leeftijdsgroepen een vaccineffectiviteit zien van 25 tot 52 procent tegen alle influenzavirussen.15 Deze vaccineffectiviteit varieerde van 55 tot 68 procent tegen influenza A(H1N1)pdm09-virus, was minder dan 8 procent tegen influenza A(H3N2)-virus en varieerde van 36 tot 54 procent tegen influenza B-virus.
Vaccinsamenstelling voor het seizoen 2018/2019
In februari 2018 adviseerde de WHO voor het noordelijk halfrond de volgende samenstelling van het influenzavaccin:16
- A/Michigan/45/2015 (H1N1)pdm09-achtig virus;
- A/Singapore/INFIMH-16-0019/2016 (H3N2)-achtig virus;
- B/Colorado/06/2017-achtig virus, van de Victorialijn;
- B/Phuket/3073/2013-achtig virus, van de Yamagatalijn.
Voor trivalente vaccins zoals die in Nederland in het seizoen 2018/2019 worden gebruikt, wordt de B-component van de Victorialijn aanbevolen.
Gevoeligheid voor antivirale middelen
Tijdens het seizoen 2017/2018 werden 774 virussen onderzocht op gevoeligheid voor neuraminidaseremmers, waaronder 233 A(H1N1)pdm09-, 355 A(H3N2)- en 156 type B-influenzavirussen, en enkele A(H1N1)pdm09- en A(H3N2)-virussen op gevoeligheid voor M2-blokkers. Eén A(H1N1)pdm09-virus had een sterk verlaagde gevoeligheid voor oseltamivir als gevolg van een 275H/Y polymorfisme in het NA-gen. Van de patiënt van wie dit virus afkomstig was, zijn geen aanvullende klinische en behandelingsgegevens bekend. De A(H3N2)- en A(H1N1)pdm09-influenzavirussen waren resistent tegen M2-ionkanaalblokkers; wereldwijd is dit het geval voor nagenoeg alle A(H3N2) en A(H1N1)pdm09-virussen.
Conclusie
Over de influenza-epidemie van het seizoen 2017/2018 zijn een aantal opvallende zaken te melden. Allereerst duurde de epidemie relatief lang en was deze met 18 weken de op een na langste influenza-epidemie in Nederland. Bijzonder was ook het hoge aantal ouderen met een longontsteking tijdens de influenza epidemie en de scherpe piek van recordhoogte in de totale sterftecijfers rond week 10, die deels zijn toe te schrijven aan influenza. Het seizoen werd gedomineerd door influenzavirus type B van de Yamagatalijn, terwijl een B-virus van de Victorialijn in het trivalente vaccin zat. Toch was de vaccineffectiviteit in Nederland 44 procent en bij ouderen zelfs 56 procent. Naar het einde van de epidemie werden steeds meer A(H3N2)- en A(H1N1)pdm09-virussen gedetecteerd, terwijl in voorgaande seizoenen juist eerst de A-virussen domineerden, gevolgd door een staartje van de epidemie met type B-virussen. Ook werd een zeldzame casus van infectie met een seizoensreassortant A(H1N2)-virus gedetecteerd.
Dankbetuigingen
Wij zijn zeer erkentelijk voor de bijdragen van de peilstationhuisartsen van Nivel Zorgregistraties eerste lijn (registratie van gevallen van IAZ en verzending van klinische monsters naar het NIC-RIVM), die essentieel zijn voor de influenzasurveillance in Nederland. Zonder de bereidwilligheid van de diagnostische laboratoria om influenzavirusmonsters naar NIC-Erasmus MC te sturen, was deze surveillance evenmin mogelijk geweest.
The authors gratefully acknowledge the generous gift of influenza reference viruses and antisera from dr. J. McCauley from the World Influenza Centre in London.
De auteurs danken verder R. van Beek, M. Pronk, M. Silva (NIC-Erasmus MC), M. Bagheri, T. Marzec, G. Goderski, S. van den Brink, L. Wijsman, P. Overduin, dr. T. Janssens, drs. D. Reukers, drs. F. Dijkstra en dr. A. Teirlinck (NIC-RIVM), en E. Wentink, M. Heshusius-van Valen en J. Gravestein (Nivel) voor de uitstekende technische ondersteuning.