Op donderdag 30 januari jongstleden bestelden we een drietal oligo’s. Twee primers en een probe. Van die laatste niet een té grote hoeveelheid want het gaat toch weer om een paar honderd euro en dat voor een PCR waarvan we geen idee hadden of we die ooit gingen gebruiken. De oligo’s waren bedoeld voor het zogeheten Wuhan-coronavirus en er moest nog een validatievoorstel worden opgesteld, zo staat te lezen in de notulen van het technisch laboratoriumoverleg van die dag. Vervolgens was met hulp van collega’s uit het LUMC de PCR (inclusief confirmatie-PCR’s) operationeel gemaakt en werd de validatie afgerond.
Inmiddels was al bekend dat de uitbraak in Wuhan serieus was. Het leek weliswaar nog ver weg, maar de uitbraken met SARS en MERS eisten destijds vele levens. SARS en MERS hebben Nederland echter nooit bereikt, en het besluit om de oligo’s voor het Wuhan-coronavirus toch maar te bestellen deed ons twijfelen of het geen weggegooid geld was. De oligo’s voor MERS zijn immers ook nooit aangeraakt en zitten nog in de vriezer.
Telefoontje
Op 27 februari werd de eerste patiënt in Brabant positief bevonden en drie dagen later kregen we het eerste verzoek voor een PCR-bepaling binnen. De verantwoordelijke arts-microbioloog had op de avond waarop we deze eerste test uitvoerden, de maandelijkse vergadering van de medische staf, waarin de opname van een voor COVID-19-verdachte patiënt besproken werd. Hij verzocht om die uitslag ook tijdens die vergadering door te bellen. Die avond zagen we in de PCR-run behalve de positieve controle nóg een curve: die van de patiënt. Onze eerste positieve patiënt was, na confirmatie uiteraard, een feit en de arts-microbioloog kreeg tijdens de stafvergadering zijn telefoontje. Het voelde een beetje als het briefje van Bruins. Het was weliswaar spannend, maar wat ging dít betekenen? Dat weten we nu.
Alarmbel
Toch broedde er al iets. Er deden berichten de ronde dat enkele grote leveranciers van RNA/DNA-extractiematerialen tegen tekorten gingen lopen. Nu wil het geval dat ons laboratorium juist géén gebruikmaakt van die betreffende leveranciers. Met andere woorden, er leek geen belemmering in het uitbreiden van de PCR voor SARS-CoV-2 naar misschien wel tientallen per dag. Toch bevreemdde het dat we enige weken later een telefoontje kregen van onze leverancier van RNA/DNA-extracties dat we “in verband met allocering van materialen” onze standing-order iets zouden moeten oprekken om levering te kunnen garanderen. Er kon niet bij verteld worden om welke materialen het dan zou gaan. Dit was een alarmbel die we nog niet eerder gehoord hadden. Want op zo’n moment kom je aan een wezenlijk onderdeel van de (moleculaire) diagnostiek: spullen.
Extractievrije PCR-methode
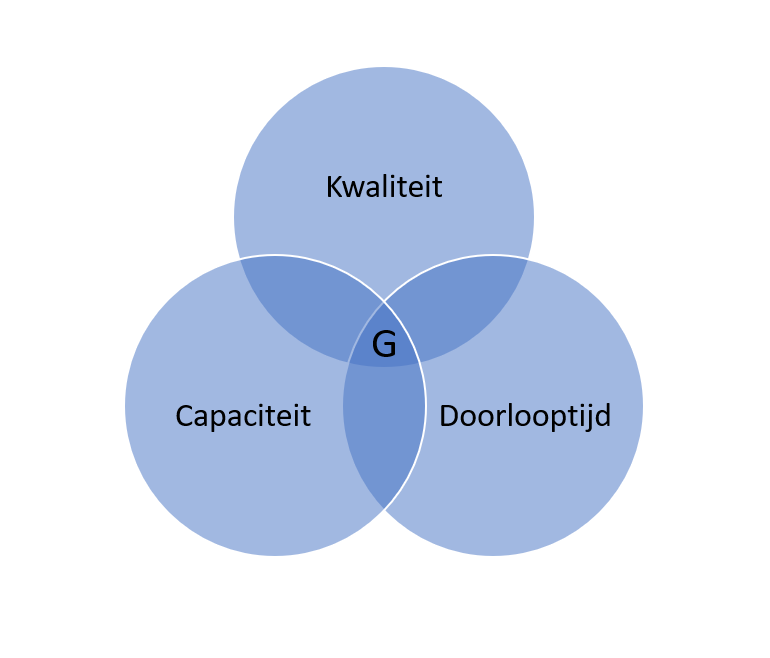
De medisch-microbiologische diagnostiek is in Nederland gevat in het ISO15189-kwaliteitssysteem en borgt samen met andere regelingen en richtlijnen zowel de kwaliteit aan de laboratoriumtafel als de levering van de resultaten aan het zorgsysteem op een veilige en betrouwbare wijze, opdat de zorg voor de patiënt optimaal en zonder restricties is. Hierin zijn in ieder geval drie pijlers aan te wijzen: kwaliteit, capaciteit en doorlooptijd (figuur 1).
Een onbalans in deze drie pijlers zal de grootte van driehoek G echter doen verkleinen. Hierin is de parallel zichtbaar met de capaciteit van de intensive-careafdelingen. Wanneer de vraag naar capaciteit te groot wordt, zullen keuzes in kwaliteit en doorlooptijd gemaakt moeten worden om G te handhaven, hetgeen kan leiden tot triageren. Geen wenselijke situatie.
In ons laboratorium is gekozen voor een aanvankelijk drie-, later viersporenbeleid om die capaciteit én doorlooptijd te borgen bij een behoud van kwalitatief gegarandeerde diagnostiek (G):
- inzetten van externe capaciteit van niet-medisch-microbiologische laboratoria (niet-MML);
- inzetten van extractie- en pipetteercapaciteit van andere diagnostiek (onder meer SOA);
- versneld valideren en implementeren van reeds aangeschafte maar nog niet geïmplementeerde extractierobot(s);
- opzetten van een extractievrije PCR-methode.
Uiteindelijk hebben we tot nu toe geen gebruik hoeven te maken van de extractiecapaciteit van een niet-MML. Vooral omdat de gewenste doorlooptijd moeilijk realiseerbaar zou zijn. Het omzetten van de bestaande extractiemethoden kon bij ons te weinig capaciteit opleveren, ook omdat de normale diagnostiek bleef doorlopen, al was de omvang hiervan wel minder dan gebruikelijk en kon de implementatie en inzet van een reeds aangeschafte extractierobot ook wat druk van de ketel halen. Uiteindelijk heeft het opzetten van een extractievrije PCR-methode het mogelijk gemaakt om de gewenste capaciteit, met de gewenste doorlooptijd en kwaliteit te halen. Deze handmatige(!) methode eist dat er secuur gelet moet worden op de verwerking van de monsters, om contaminatie en monsterverwisseling te voorkomen. Confirmatie van positieve materialen vanaf het primaire materiaal is daarbij noodzakelijk. Het heeft een flinke inspanning gevergd van de medisch-moleculair microbiologen en labmanagers, maar vooral ook van de moleculair analisten om deze omslag te maken. Immers, de gehele logistiek moet worden aangepast, de kwaliteitsborging gegarandeerd, en de werktijden verruimd. Dit geldt niet alleen voor het moleculaire laboratorium, maar ook voor het verplegend personeel, de administratie en de bodes, die deze stortvloed aan monsters afneemt, registreert en aflevert.
700 monsters dagelijks
Niet alleen in het laboratorium, ook aan het bed van de patiënt blijken tekorten te ontstaan: afnamematerialen! De vertrouwde en gevalideerde e-swab blijkt door de fabrikant al snel niet meer te leveren, wat tot gevolg heeft dat er een bonte verzameling aan afnamemedia binnenkomt via zes verschillende ziekenhuizen, twee GGD´en, de VVT’s (verpleeg- en verzorgingshuizen) en huisartsenposten, die elk wisselende voorraden hadden en ook zelf receptacula aanschaften naast de door ons uitgeleverde swabs. De geschiktheid voor virusdetectie kan daarom pas achteraf gevalideerd worden, dus nadat de eerste patiënten hiermee zijn bemonsterd en de testen zijn uitgevoerd. Niet de volgorde die je wenst, maar in crisistijd lukt vooraf valideren niet altijd en soms waren rectificaties nodig. Werkwijzen rond de monsterbewerking zijn keer op keer aangepast.
De analisten konden het aan om dag na dag 700 monsters te verwerken geleverd in wel tien verschillende receptacula! Welk geautomatiseerd platform met zijn veelal fabrikanteigen receptaculum en werkwijze kan die flexibiliteit leveren?
Lessen
Inmiddels is het eind april en neemt de vraag naar coronadiagnostiek langzaam af. Deze afname houdt gelijke tred met de afname van de aantallen opgenomen patiënten. Een veel sterkere afname is er in het aantal positieve monsters, want er worden nu steeds meer personeelsleden van zorginstellingen bemonsterd en gelukkig zijn deze veelal negatief voor het coronavirus. De voorspellingen van het toekomstige aantal monsters voor coronadiagnostiek zal naar verwachting meedeinen met de bezetting van de intensive-careafdelingen, maar ook met de uitbreiding van het testbeleid zoals door de overheid nu wordt ingezet. Op basis hiervan kunnen we ons vanaf nu beter voorbereiden, of anders gezegd: ons niet meer laten verrassen. Wanneer de rust straks weer iets terugkomt, moet er aandacht besteed worden aan de opschaalbaarheid van onze laboratoria. We hebben geleerd dat hierbij een vergaande onafhankelijkheid van de gebruikelijke leveranciers noodzakelijk is. Lysisbuffers of reagenscartridges, maar ook afnamematerialen en transportmedia horen geen belemmering te vormen voor deugdelijke diagnostiek, zeker niet bij een pandemie zoals we die nu meemaken. De verantwoordelijkheid voor de kwaliteit en continuïteit van diagnostiek ligt immers bij het laboratorium en kan niet bij de leverancier worden gelegd. Het laboratorium moet dan ook in staat blijven om zijn eigen generieke materialen te gebruiken om die continuïteit van zorg te kunnen garanderen. De patiënt heeft dan ook nog steeds baat bij een goede kwaliteit en de ISO15189-normering heeft daarmee zijn nut bewezen. De CE-IVD-certificering heeft tot op heden echter geen rol gespeeld in het snel aantonen en monitoren van dit nieuwe virus; de zogeheten Corman-test (voor het aantonen van SARS-CoV-2) was namelijk al binnen enkele dagen na het vrijgeven van de RNA-sequentie opgezet en wereldwijd gedeeld met de laboratoria. Wanneer op die certificering gewacht had moeten worden, stonden we nu pas aan het begin van het uitgebreid en laagdrempelig testen. Als de CE-IVD-certificering in de toekomst – als de rust op het laboratorium en in het land teruggekeerd is – weer een issue is, mag het belang ervan opnieuw verdedigd worden door de voorstanders ervan, maar nu met de ervaringen tijdens de coronacrisis vers in het geheugen.