Samenvatting
Surveillance van zorginfecties is een fundamenteel onderdeel van infectiepreventieprogramma’s. Het toenemende gebruik van elektronische ziekenhuisinformatiesystemen maakt (semi-)geautomatiseerde surveillance van zorginfecties mogelijk. Dit gaat gepaard met hogere kwaliteit dankzij betere standaardisatie en gereduceerde werklast. Er zijn verschillende methoden van geautomatiseerde surveillance, waarbij de elektronische beschikbaarheid van hoogwaardige klinische gegevens en een juiste digitale infrastructuur noodzakelijk is. Het versterken van kennis over deze methoden en het vaststellen van een gezamenlijke visie op geautomatiseerde surveillance is nodig om ziekenhuizen te ondersteunen bij het ontwikkelen van kwalitatief hoogwaardige systemen, het doelmatig inzetten van beschikbare middelen en het borgen van de vergelijkbaarheid van resultaten tussen ziekenhuizen.
Summary
Surveillance of healthcare-associated infections is a cornerstone of infection prevention programs. The increasing adoption of electronic health records facilitates the development and implementation of (semi-)automated surveillance systems, hence improving standardization and reducing workload. Several methods of automated surveillance are available; in all cases high-quality clinical data and adequate data infrastructure are essential requirements. Expanding our knowledge and developing a shared agenda of automated surveillance system development is required to support hospitals in achieving high-quality surveillance systems, efficiently employing available resources and ensuring comparability of results.
Inleiding
Infecties die optreden ten gevolge van medische zorg, zogeheten zorginfecties of zorggerelateerde infecties treden op bij naar schatting 4 procent van patiënten in Nederlandse ziekenhuizen. Dit zijn met name postoperatieve wondinfecties (POWI), lijninfecties, pneumonie- en urineweginfecties. Deze zorginfecties brengen een aanzienlijke ziektelast en bijbehorende kosten met zich mee en worden grotendeels als vermijdbare complicaties beschouwd.1-3 Halvering van het aantal vermijdbare zorginfecties is dan ook een van de doelstellingen uit de landelijke ‘Aanpak antibioticumresistentie’. 4 Systematische surveillance van het optreden van zorginfecties en het terugkoppelen van de incidentiecijfers aan zorgverleners en andere betrokkenen zijn van bewezen belang voor het vóórkomen van deze complicatie, en een fundamenteel onderdeel van programma’s om preventiedoelstellingen te halen.5 Surveillance biedt inzicht in de incidentie van infecties, en daarmee handvatten voor preventie en de mogelijkheid om het effect van preventieve maatregelen te kwantificeren.
Conventionele surveillance bestaat uit handmatig retrospectief statusonderzoek van alle patiënten die in de doelgroep vallen, bijvoorbeeld omdat zij een specifieke ingreep hebben ondergaan. Hierbij wordt door deskundigen infectiepreventie of andere aangewezen professionals volgens gestandaardiseerde criteria vastgesteld of de patiënt de betreffende zorginfectie heeft ontwikkeld. Dit proces is arbeidsintensief en foutgevoelig, zoals blijkt bij nauwkeurig controleren van de resultaten.6,7 Dankzij het toenemende gebruik van elektronische ziekenhuisinformatiesystemen zijn steeds meer klinische patiëntengegevens elektronisch beschikbaar en wordt het mogelijk (semi-)geautomatiseerde surveillance uit te voeren. Het gebruik van geautomatiseerde systemen gaat gepaard met hogere kwaliteit door betere standaardisatie en gereduceerde werklast.8,9
Dit artikel bespreekt de verschillende mogelijkheden om (semi-)geautomatiseerde surveillance van zorginfecties vorm te geven en de daarvoor benodigde databronnen en digitale infrastructuur. Daarnaast worden enkele voorbeelden uit de praktijk besproken, alsmede hindernissen bij het inrichten van effectieve en kwalitatief hoogwaardige geautomatiseerde surveillance.
Geautomatiseerde surveillance
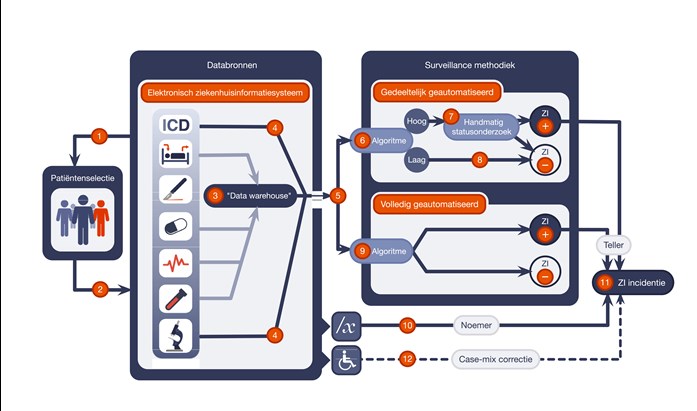
Geautomatiseerde surveillance van zorginfecties kan geheel of gedeeltelijk geautomatiseerd zijn (figuur 1).10,11 In semi-geautomatiseerde surveillance worden gegevens uit elektronische ziekenhuisinformatiesystemen door een algoritme gebruikt om patiënten te selecteren die mogelijk een zorginfectie hebben ontwikkeld (zogeheten ‘hoge kans’). Deze patiënten worden vervolgens onderworpen aan handmatig statusonderzoek om tot een definitieve conclusie te komen. Patiënten die zijn geclassificeerd als ‘lage kans’ op een zorginfectie worden niet verder beoordeeld en gecategoriseerd als ‘geen zorginfectie’. In volledig geautomatiseerde surveillance vindt er geen handmatige beoordeling plaats, het algoritme stelt de aanwezigheid van een infectie vast.
Semi- en volledige geautomatiseerde surveillance hebben elk voor- en nadelen (tabel). De handmatige beoordelingsstap in semi-geautomatiseerde surveillance betekent dat de werklast niet geheel geëlimineerd wordt, maar die stap maakt wel een genuanceerde interpretatie van gegevens mogelijk. Bij volledig geautomatiseerde surveillance is er geen ruimte voor subjectieve interpretatie, wat standaardisatie kan bevorderen. Maar om dit te bewerkstelligen moeten definities zodanig aangepast worden dat deze op gestructureerde, elektronisch beschikbare gegevens toepasbaar zijn; in de meeste gevallen worden hiertoe klinische criteria (zoals koorts, roodheid of de aanwezigheid van andere foci van infectie) uit de definitie verwijderd.12 Dit kan het klinisch draagvlak voor de gevonden infecties verminderen, en mogelijk worden daarmee de verkregen surveillanceresultaten minder bruikbaar voor het uitvoeren van kwaliteitsprojecten. De meeste semi-en volledig geautomatiseerde surveillance systemen beperken zich tot ernstige zorginfecties, zoals diepe POWI en bacteriemie.
De meest-gebruikte algoritmen berusten op het gebruik van puntenscores, regressiemodellen of beslisbomen om patiënten in te delen in wel of niet een (hoge kans op een) zorginfectie.13-15 In recente jaren wordt er ook gekeken naar mogelijkheden van ‘machine learning’ of artificiële intelligentie voor volledig geautomatiseerde surveillance. Deze systemen zijn veelbelovend, maar complexer om te implementeren. Daarnaast moet hun meerwaarde nog onderzocht worden en is er nog weinig bekend over acceptatie van de resultaten van dergelijke surveillancesystemen in de kliniek.16,17
Databronnen voor geautomatiseerde surveillance
Ongeacht de keuze voor een type geautomatiseerde registratie is het ontsluiten van de benodigde gegevens uit het elektronische ziekenhuisinformatiesysteem een voorwaarde. De meest gebruikte bronnen in huidige algoritmen zijn gegevens die opgeslagen worden in gestructureerde velden: resultaten van microbiologisch onderzoek, (her)opnames en (her)operaties, antibioticumgebruik en diagnose- of ontslagcodes. In specifieke gevallen worden ook radiologische interventies of klinisch-chemische bepalingen meegenomen. Naast gegevens die nodig zijn voor de identificatie van mogelijke infecties, moeten ook gegevens worden verzameld om patiënten te includeren en om exclusiecriteria toe te passen (bijvoorbeeld het onderscheid tussen primaire en niet-primaire ingreep). Waar extractie van gegevens niet mogelijk is moet de surveillance aan de beschikbaarheid van deze gegevens worden aangepast. Surveillance binnen overkoepelende kwaliteitsprogramma’s, waarbij sprake is van benchmarking, vergt ook het geautomatiseerd verzamelen van gegevens over de samenstelling van de patiëntenpopulatie (case-mix). Door algoritmen zodanig te ontwikkelen dat deze uitsluitend gebruikmaken van gegevens die alle ziekenhuizen worden geregistreerd, kan de vergelijkbaarheid tussen ziekenhuizen gefaciliteerd worden.
Het routinematige (her)gebruik van gegevens uit ziekenhuisinformatiesystemen stelt eisen aan de kwaliteit en standaardisatie van de elektronisch verzamelde gegevens. Daarnaast moet de validiteit voor gebruik in automatische surveillance worden beoordeeld; de gegevens zijn immers met een ander doel vastgelegd en kunnen hierdoor een andere betekenis hebben. Diagnose- en ontslagcodes, die meestal worden vastgelegd voor epidemiologische of financiële doeleinden, zijn over het algemeen inferieur aan klinische gegevens voor het doel van surveillance.18 Daarnaast is borging van de kwaliteit van de ingevoerde gegevens en regulier onderhoud van data-extracties een voorwaarde om deze gegevens in de routinesurveillance op te nemen. Zo moeten wijzigingen in informatiesystemen ook doorgevoerd worden in de data-analyses en is periodieke controle van de volledigheid van de gegevens cruciaal om de validiteit van de resultaten te garanderen.
In de literatuur zijn ook surveillancesystemen beschreven die putten uit vrije tekstvelden zoals decursusnotities en radiologierapporten.19 De meerwaarde van dit ‘tekst-mining’ boven gegevens die beschikbaar zijn in gestructureerde velden is niet uitgebreid onderzocht, maar lijkt voor infectieregistratie beperkt te zijn. De complexiteit van dergelijke analyses maakt dat dit nog weinig wordt gebruikt in de dagelijkse praktijk.19
Data-infrastructuur voor geautomatiseerde surveillance
Het uitvoeren van geautomatiseerde registratie vergt daarnaast een ondersteunde digitale infrastructuur met een aantal functionaliteiten die handmatige stappen in het proces van registratie vervangen:
- Inclusie van patiënten voor wie registratie moet worden uitgevoerd (noemer) door middel van automatische of bulkselectie, bijvoorbeeld op basis van operatiecodes of de aanwezigheid van centrale lijnen; hierbij dient rekening te worden gehouden met in- en exclusiecriteria.
- Het creëren van een databank met gegevens uit het ziekenhuisinformatiesysteem en het hierop kunnen toepassen van een algoritme, bijvoorbeeld met een statistisch softwarepakket.
- Een systematiek om op patiëntniveau - zonder individuele dossiers te openen - uitkomsten van het algoritme te registreren (volledig geautomatiseerd) of te beoordelen of handmatig statusonderzoek nodig is (semi-geautomatiseerd).
- Een systematiek om voor patiënten met een (mogelijke) zorginfectie aanvullende gegevens te registreren, zoals confirmatie van de zorginfecties of risicofactoren.
- De mogelijkheid om gegevens over geïncludeerde patiënten en geregistreerde infecties te extraheren (teller/noemer-data) alsmede gewenste gegevens voor case-mixcorrectie.
Deze digitale infrastructuur kan binnen of buiten het elektronisch ziekenhuisinformatiesysteem vormgegeven worden, bijvoorbeeld in specialistische programma’s. In beide gevallen is nauwe samenwerking tussen medisch specialisten, deskundigen infectiepreventie en de beheerders van het elektronische patiëntendossier nodig, evenals regelmatig onderhoud en controle van het geheel van extractie en analyses.
Voorbeelden uit te praktijk
Semi-geautomatiseerde surveillance
Semi-geautomatiseerde surveillance van POWI is in een beperkt aantal ziekenhuizen de routine van surveillance geworden. Voor de surveillance van diepe POWI na onder andere heup- en knieprothesiologie, geïnstrumenteerde ingrepen aan de wervelkolom en openhartoperaties is semi-geautomatiseerde surveillance geïmplementeerd in het elektronisch ziekenhuisinformatiesysteem van het UMC Utrecht. Met gevalideerde algoritmen, gebaseerd op microbiologieresultaten, heroperaties, heropnames en antibioticumgebruik wordt onderscheid gemaakt tussen patiënten met een lage en hoge kans dat zij een POWI hebben ontwikkeld. Voor de surveillance na heup- en knieprothesiologie wordt hiermee een sensitiviteit van 100 procent ten opzichte van handmatige surveillance behaald, en een werklastreductie van 95 procent.20 Met dezelfde gegevens wordt bij de cardiochirurgie een sensitiviteit gehaald van ongeveer 98 procent voor diepe POWI aan sternum én been, met een werklastreductie van 90 procent (ongepubliceerde data). Sinds de ingebruikname is de doorlooptijd van surveillance aanzienlijk verkort, en het streven is om terugkoppeling aan de clinici via een digitaal platform mogelijk te maken. Ook uit andere centra zijn er voorbeelden van semi-geautomatiseerde surveillance beschreven, zowel in de onderzoeksfase als na implementatie.21,22
Volledig geautomatiseerde surveillance
In Denemarken vindt geautomatiseerde surveillance op landelijk niveau plaats binnen het HAIBA-programma.23 Microbiologische resultaten, interventies, opnames, diagnose codes en antibioticumgebruik worden met unieke identificatienummers op landelijk niveau aan elkaar gekoppeld en op basis van algoritmes wordt een specifieke infectie vastgesteld. Hierbij wordt er geen statusonderzoek uitgevoerd en algoritmes zijn niet aangepast aan het specifieke ziekenhuis. Ter illustratie, het vaststellen van een diepe POWI na het plaatsen van een heupprothese vindt plaats op basis van een re-operatie plus ten minste twee positieve weefselkweken met hetzelfde micro-organisme. Validatie van deze algoritmes is gedaan ten opzichte van prevalentiedata (in tegenstelling tot incidentie); het is daarmee niet geheel duidelijk hoe de gevonden incidentiecijfers zich verhouden tot de incidentie verkregen door handmatige surveillance.24 Op een openbare website kan per ziekenhuis(afdeling) de incidentie van de betreffende infecties worden opgezocht. In hoeverre de rapportages binnen ziekenhuizen worden gebruikt voor kwaliteitsverbetering wordt niet beschreven.
In de Verenigde Staten wordt ook gewerkt naar volledig automatiseerbare surveillance, met de daarbij horende aanpassingen van definities.12 Temeer omdat hier financiële consequenties worden verbonden aan de gerapporteerde incidentie van zorginfecties, wordt er veel waarde gehecht aan maximale standaardisatie. De volledige automatisering van surveillance heeft mogelijk wel negatieve consequenties voor de klinische acceptatie van de gemeten incidentie en het is gebleken dat automatisering op zichzelf geen garantie biedt voor vergelijkbaarheid van data.11
Knelpunten en uitdagingen bij implementatie
Er zijn nog wel enkele omstandigheden die de grootschalige implementatie van geautomatiseerde surveillance hinderen. Gegevens uit elektronische ziekenhuisinformatiesystemen zijn niet altijd goed toegankelijk en vaak niet gestandaardiseerd; veel ziekenhuizen beschikken niet over een centrale ‘clinical data warehouse’ waar klinische gegevens routinematig opgevraagd kunnen worden. Informatie moet dan uit meerdere bronnen bij elkaar gezocht worden, hetgeen datamanagement en onderhoud bemoeilijkt. Daarnaast is binnen afdelingen infectiepreventie vaak niet de specialistische kennis aanwezig om de gegevens te verkrijgen en analyseren. Specialistische softwarepakketten kunnen afdelingen wel ondersteunen. Daarnaast bemoeilijken periodieke wijzigingen in ziekenhuisinformatiesystemen de extractie van (historische) gegevens en daarmee de validatie en implementatie van algoritmen. De toenemende aandacht voor (her)gebruik van elektronisch opgeslagen gegevens en de wens om registratielast te verminderen zal hopelijk leiden tot verbeteringen in digitale infrastructuur.25 Hierbij is adequate standaardisatie, eenheid van taal en goed onderhoud van de systemen cruciaal om een duurzame omslag naar geautomatiseerde surveillance mogelijk te maken. Bovendien kunnen mogelijkheden, afhankelijk van de opzet van grootschalige infrastructuur, worden beperkt door de nieuwe Algemene Verordening Gegevensbescherming.
Ten aanzien van de inhoudelijke inrichting van geautomatiseerde surveillance zijn er nog openstaande vragen; er moet een keuze worden gemaakt in de mate van automatisering (semi- of volledig geautomatiseerd), de gebruikte databronnen, het zo nodig aanpassen van definities en de mogelijkheid tot case-mixcorrectie op basis van elektronisch verkregen gegevens. Bestaande systemen zijn veelal ontwikkeld in een enkel ziekenhuis en ze zijn daarmee divers in doelstelling en inhoud. In hoeverre systemen toepasbaar zijn in andere klinieken moet nog onderzocht worden.
Om de overstap naar geautomatiseerde surveillance te ondersteunen wordt in samenwerking met PREZIES onderzoek gedaan naar de toepasbaarheid en validiteit van het semi-geautomatiseerde surveillance model voor diepe POWI na heup- en knieprothesiologie in verschillende Nederlandse ziekenhuizen. Daarnaast loopt een Europees multicenteronderzoek naar de mogelijkheden voor prospectieve ontwikkeling van surveillance-algoritmen en naar de mogelijkheden van standaardisatie tussen ziekenhuizen.
Conclusie
Geautomatiseerde surveillance van zorginfecties op basis van routinematig opgeslagen gegevens in ziekenhuisinformatiesystemen heeft de potentie om de kwaliteit van infectieregistratie te verbeteren en de registratielast te verminderen. Hiertoe is de elektronische beschikbaarheid van hoogwaardige klinische gegevens en de juiste digitale infrastructuur noodzakelijk. Toekomstig onderzoek zal de kennis vergroten over de toepasbaarheid van geautomatiseerde surveillance op lokaal en grootschaliger niveau. Het versterken van kennis over deze methoden en het vaststellen van een gezamenlijke visie op geautomatiseerde surveillance is nodig om ziekenhuizen te ondersteunen bij het ontwikkelen van kwalitatief hoogwaardige systemen, het doelmatig inzetten van beschikbare middelen en het borgen van de vergelijkbaarheid van resultaten tussen ziekenhuizen.