Samenvatting
Infecties met carbapenemase-producerende Enterobacteriaceae (CPE) zijn moeilijk te behandelen en leiden tot hoge morbiditeit en mortaliteit. Adequate infectiepreventiemaatregelen voor CPE vereisen sensitieve screeningsmethodes.
We vergeleken de resultaten na directe inoculatie van 25 bekende CPE-isolaten op twee selectieve agarplaten: de sensitiviteit was 96 procent voor de Supercarba-agar (Nordmann) en 88 procent voor de gecombineerde ChromID-agarplaten (ChromID carba plus ChromID OXA-48, bioMérieux). Het gebruik van een ophopingsbouillon (~25 kve) verhoogde de sensitiviteit van de Supercarba-agar naar 100 procent, en de sensitiviteit van de gecombineerde ChromID-agarplaten naar 92 procent.
Vervolgens zijn zowel de Supercarba-agar als de gecombineerde ChromID-agarplaten geëvalueerd met behulp van een ophopingsbouillon, als CPE-screeningsmethode in een typisch Nederlandse setting: 307 rectale swabs uit een puntprevalentie-onderzoek in een ziekenhuis waren negatief voor CPE. De specificiteit van de Supercarba-agar was 92,8 procent, de specificiteit van de gecombineerde ChromID-platen was 97,4 procent.
Inmiddels is bij 11 patiënten CPE-kolonisatie aangetoond via deze selectieve CPE-kweek; bij vijf patiënten kwam de CPE niet uit de gelijktijdig ingezette ESBL-kweek. Eén patiënt die wel werd gekweekt op de gecombineerde ChromID-agars werd gemist op de Supercarba-agar. Drie patiënten werden wel gekweekt op de Supercarba-agar maar gemist in de ChromID-agars.
We concluderen dat de ophopingsstap de sensitiviteit van de CPE-kweek verhoogt en dat de selectieve CPE-kweek sensitiever is dan de ESBL-kweek in het detecteren van CPE-kolonisatie.
Abstract
Infections with carbapenemase-producing Enterobacteriaceae (CPE) are difficult to treat, resulting in high morbidity and mortality. Effective infection control measures for CPE require sensitive screening methods. We compared results from direct inoculation of 25 known CPE isolates on two selective agar plates: the sensitivity was 96 percent for Supercarba-agar (Nordmann) and 88 percent for the combined ChromID-agar plates (ChromID carba en ChromID OXA-48, bioMérieux). The use of an enrichment broth (~25 cfu) increased the sensitivity of the Supercarba-agar to 100 percent, and the sensitivity of the combined ChromdID-agar plates to 92 percent.
We subsequently evaluated both the Supercarba-agar and combined ChromID-agar plates, using broth enrichment, in a typical Dutch setting: 307 rectal swabs from a hospital screening survey were CPE-negative. The specificity of the Supercarba-agar was 92.8 percent, the specificity of the combined ChromID-agar plates was 97.4 percent.
Using this culture method in routine screening, 11 patients were identified as colonized with CPE; five were negative for CPE in the simultaneous ESBL culture. One patient was missed using the Supercarba-agar; three patients were missed using the ChromID-agars. We conclude that broth enrichment enhances the sensitivity of selective agar plates and selective CPE culture enables more sensitive detection of CPE colonization than ESBL culture.
Introductie
De toename in antimicrobiële resistentie is een wereldwijde bedreiging voor de gezondheid, zoals ook onderstreept door de oproep van de Wereldgezondheidsorganisatie. Infecties met resistente micro-organismen zijn vaak moeilijk te behandelen, wat leidt tot verhoogde morbiditeit en mortaliteit en hogere kosten in de gezondheidszorg.1,2 Een van de meest zorgwekkende klassen van bijzonder resistente micro-organismen (BRMO's) zijn de carbapenemase-producerende Enterobacteriaceae (CPE). CPE zijn gramnegatieve bacteriën die resistent zijn tegen de reserveantibiotica carbapenems, waartoe middelen als meropenem en imipenem behoren. De meeste CPE produceren tevens extended-spectrum bètalactamasen (ESBL) en zijn coresistent tegen andere antibioticumklassen zoals fluorchinolonen en co-trimoxazol, wat resulteert in een panresistent fenotype.3 Naast patiënten met een infectie met CPE kunnen ook patiënten met asymptomatische CPE-kolonisatie een bron zijn van nosocomiale transmissie.
Infectiepreventiemaatregelen zijn nodig om verspreiding van CPE in een ziekenhuis te voorkomen. De WIP-richtlijn BRMO uit 2012 adviseert om patiënten met CPE in isolatie te verplegen.4 Enfield et al. toonden aan dat het infectierisico met CPE afnam na implementatie van de Centers for Disease Control and Prevention’s 2012 CPE-toolkit.5 Hiervoor is het nodig om patiënten met CPE adequaat te identificeren, zowel door klinische isolaten als met screening of puntprevalentieonderzoek.
Nederland is succesvol in infectiepreventie en het voeren van een restrictief antibioticumgebruik.6 Hierdoor is de prevalentie van antibioticumresistentie laag in vergelijking met andere landen. Methicilline-resistente Staphylococcus aureus (MRSA)-prevalentie in positieve bloedkweken bijvoorbeeld, is met 1,2 procent substantieel lager dan het gemiddelde van de Europese unie met 13,7 procent.7 Ook de prevalentie van CPE in Nederland is relatief laag, met respectievelijk 0,03 procent en 0,42 procent bevestigde carbapenem-resistente E. coli en K. pneumoniae in 2017.8,9 Desalniettemin zijn er ook in Nederland introducties van CPE die tot verspreiding en enkele uitbraken hebben geleid.10 Een CPE-uitbraak wordt soms pas relatief laat gedetecteerd, onder andere doordat CPE moeilijk te detecteren kunnen zijn in routinekweken: ten eerste zijn platen die niet selectief op CPE testen vaak overgroeid met morfologisch identieke isolaten zonder carbapenemase-gen, waardoor de CPE onopgemerkt blijft. Ten tweede hebben sommige carbapenemase-producerende bacteriën slechts een marginaal veranderde minimaal remmende concentratie (MRC) voor carbapenems, zodat de standaard klinische breekpunten van EUCAST deze stammen carbapenemase-gevoelig rapporteren.11,12 Hoewel CPE-screening wordt toegepast bij risicogroepen, zoals recente opname in een buitenlands ziekenhuis,4 zijn hiervoor geen gestandaardiseerde methoden beschikbaar en ontbreken actuele richtlijnen. Ook is het momenteel niet gebruikelijk om routinematig CPE-puntprevalenties uit te voeren in ziekenhuizen. Dit is waarschijnlijk een gecombineerd effect van de lage prevalentie van CPE, en de extra kosten die hiermee gemoeid zijn voor zowel de kliniek als het laboratorium.
Gezien de toename van het aantal CPE-uitbraken en hun late detectie, hebben we een studie opgezet om tot een geschikte methode te komen voor het screenen op CPE in rectale swabs. We selecteerden twee selectieve agarplaten op basis van de literatuur,13–15 beoordeelden de platen op sensitiviteit en specificiteit en evalueerden of het gebruik van een ophopingsbouillon de prestaties van de platen kan verbeteren. Vervolgens vergeleken we de opbrengst van de CPE-kweek ten opzichte van de standaard ingezette ESBL-kweek bij patiënten met een verhoogd risico op CPE, zoals recent verblijf in een buitenlands ziekenhuis.
Materiaal en methoden
Selectie van kweekmethoden
Het doel van de studie was de evaluatie van screeningmethodes voor CPE-dragerschap. Gebaseerd op literatuur,16,17 werden twee selectieve agarplaatmethodes geselecteerd: de Supercarba-agar zoals beschreven door Nordmann et al.18, en de gecombineerde ChromID-agarplaten (ChromID Carba plus ChromID OXA-48, bioMérieux).
Directe inoculatie
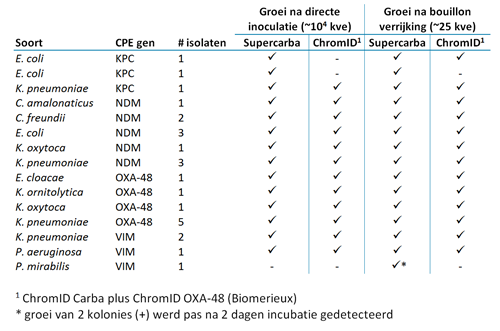
We gebruikten 25 bekende CPE-isolaten om de sensitiviteit van beide agarplaatmethoden te testen. De species werd vastgesteld met MALDI-TOF (Bruker, Duitsland). Carbapenemase-productie werd bevestigd in elk isolaat met een carbapenemase-specifieke PCR op KPC, OXA-48, VIM, IMP en NDM genen (CT103 microarray, Checkpoints, Nederland). Een 0,5 McFarland-emulsie werd gemaakt in een steriele zoutoplossing. De emulsie werd 1:100 verdund door aseptische overdracht van 0,1 ml emulsie in 9,9 ml steriele zoutoplossing, resulterend in een suspensie. De suspensie werd geïnoculeerd op de Supercarba-agarplaat en de gecombineerde ChromID Carba Smartplaten met een 10 µl steriele öse.
Inoculatie van verrijkte bouillon
Om de situatie te simuleren waarin we screenen voor CPE-kolonisatie, waar rectale swabs worden gebruikt en de concentratie van CPE in het rectale swabmedium waarschijnlijk lager is dan in de directe kweek, maakten we een verdunning van circa 250 kve/ml (geëvalueerd met kolonietelling op een bloedagarplaat). Vervolgens werd 0,1 ml van deze 250 kve/ml suspensie, circa 25 kve, geïnoculeerd in 5 ml tryptic soy broth met 8 ml/l vancomycine en 0,12 mg/l meropenem. De antibiotica zijn toegevoegd om de groei van grampositieve bacteriën te remmen en de carbapenemase-productie in CPE-isolaten te bevorderen. Na 16 tot 24 uur incubatie bij 36ᵒC werden de selectieve agar-platen geïnoculeerd met een 10 µl steriele öse.
Aflezen van de platen
Alle agars werden op twee momenten geïnspecteerd op groei: na 18 tot 24 uur en 42 tot 48 uur incubatie bij O2 op 36ᵒC. Groei op de platen werd gezien als positief. Voor de ChromID-agar werd groei op ten minste een van de platen als positief geregistreerd.
Puntprevalentiestudie en specificiteitsbepaling
De ophopingsbouillon in combinatie met afenting op de twee verschillende selectieve agarmethodes zijn gebruikt om een CPE-puntprevalentiestudie uit te voeren in een groot topklinisch ziekenhuis in het zuiden van Nederland. Als onderdeel van de routinematige puntprevalentie werd bij alle opgenomen patiënten die wensten mee te werken een rectale swab (Eswab, Copan) afgenomen. De afdelingen Pediatrie en Psychiatrie vallen niet binnen de routinematige puntprevalentie.
Alle gegroeide kolonies zijn gedetermineerd met MALDI-TOF (Bruker). Resistentie werd bepaald met Vitek-2 (bioMérieux), E-test meropenem en imipenem (bioMérieux), Carbapenem inactivation method (CIM-test),19 en een carbapenemase-specifieke qPCR (Check-Direct CPE, Checkpoints) die test op KPC-, OXA-48-, IMP- en NDM-genen.
Bij de CIM-test, zie ook Van der Zwaluw et al,19 wordt met een 10 µl öse de stam in 400 µl fysiologisch zout gesuspendeerd; hieraan wordt een meropenemdisk (MEM10, Oxoid) toegevoegd en geïncubeerd gedurende 2 uur op 35ᵒC. De disk wordt vervolgens op een plaat gelegd waarop een meropenem-gevoelige E. Coli ATCC 29522 is geënt. Indien er geen zone om de disk zichtbaar is, is de meropenem in de disk afgebroken doordat de stam een carbapenemase produceert.
De specificiteit werd berekend door het percentage agarplaten uit de puntprevalentiestudie zonder groei van Enterobacteriaceae te delen door het totaal aantal CPE-negatieve platen. Dit is apart uitgevoerd voor de Supercarba-agar en voor de gecombineerde ChromID-agarplaten. Statistische testen zijn uitgevoerd met McNemar's Chi-squared test for count data in R versie 3.4.2.
Praktijkervaring
Sinds mei 2017 wordt de selectieve CPE-kweek standaard ingezet als onderdeel van de BRMO-screening van patiënten die recent in een buitenlands ziekenhuis verbleven. We maken daarbij gebruik van de ophoping die wordt afgeënt op zowel de Supercarba-agar- als de gecombineerde ChromID-agarplaten. Gezien het ontbreken van een gouden standaard voor CPE-testen gold als referentie dat een monster CPE-positief was indien gedetecteerd op één van de CPE-platen of in een ESBL-kweek met positieve CIM-test. ESBL-screening als onderdeel van deze BRMO-screening wordt gedaan met ophopingsbouillon (tryptic soy broth met 8 mg/l vancomycine en 0,25 mg/l cefotaxim) en afenting op twee verschillende McConkey-platen: a) McConkey met cefotaxim (1 mg/l), vancomycine (64 mg/l) en oxacilline (400 mg/l) en b) McConkey met ceftazidim (1 mg/l), vancomycine (64 mg/l) en oxacilline (400 mg/l).
Resultaten
Sensitiviteit van de kweekmethode
Tabel 1 toont de groeiresultaten van de 25 verschillende CPE-isolaten voor beide selectieve agars met en zonder gebruik van de ophopingsbouillon. De analytische sensitiviteit van beide agarplaten was hoog, 96 procent voor de Supercarba-agar en 88 procent voor de gecombineerde ChromID-agarplaten. Na ophoping in bouillon nam de sensitiviteit verder toe, ondanks de lagere concentratie van het inoculum, tot 100 procent voor de Supercarba-agar en 92 procent voor de gecombineerde ChromID-agarplaten. De groei na bouillonverrijking was discreet, stammen hadden ofwel ruime groei (++++) binnen 1 dag of totaal geen groei, behalve de P. mirabilis VIM-stam.
Specificiteit van de kweekmethode
De combinatie van een ophopingsbouillon met beide platen is vervolgens ingezet tijdens de routine puntprevalentie in een groot topklinisch ziekenhuis in het zuiden van Nederland. Van de 382 patiënten die in aanmerking kwamen voor de puntprevalentie is bij 307 patiënten een rectale swab afgenomen. Deelname aan de puntprevalentie is ziekenhuisbeleid maar vrijwillig; 75 patiënten wilden niet deelnemen aan de studie of waren niet beschikbaar op het moment van screening.
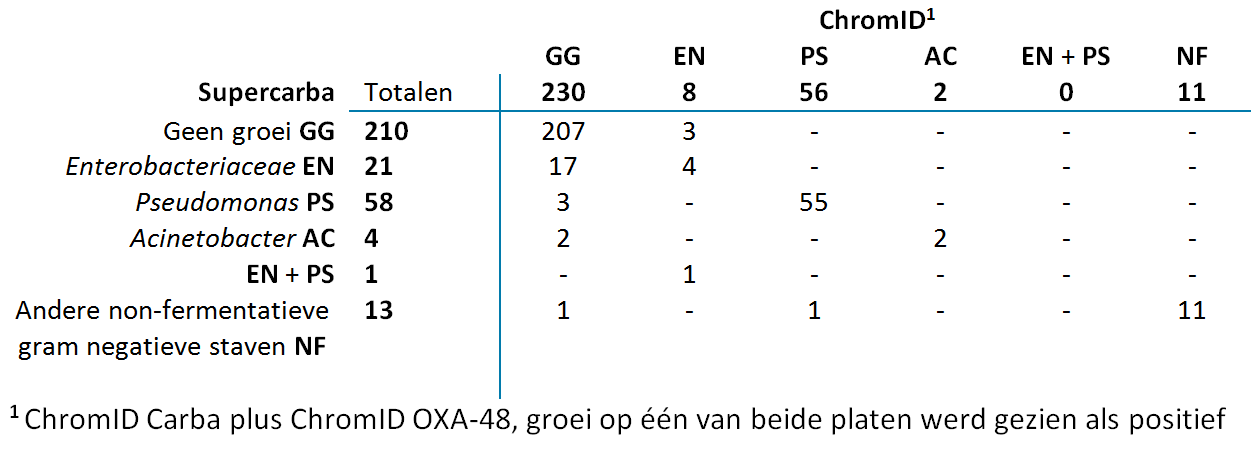
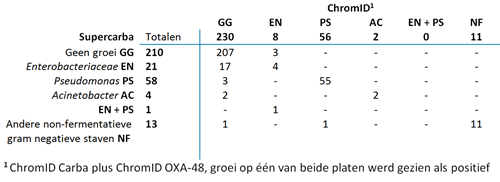
De CPE-prevalentie onder de deelnemende patiënten was 0 procent: geen van de 307 gescreende rectale swabs toonde CPE in de geteste kweekmethodes. In tabel 2 is zichtbaar dat er voor 207 swabs (67 procent) geen enkele bacteriële groei was op de verschillende platen. Enterobacteriaceae zijn gekweekt in 25 monsters (8 procent). Pseudomonas spp. werden gevonden in 58 kweken (19 procent). Op één Supercarba-plaat zijn zowel Enterobacteriaceae als Pseudomonas spp. gedetecteerd. Bij een ander monster werd Pseudomonas spp. gekweekt op de gecombineerde ChromID-agarplaten, terwijl op de Supercarba-agarplaat de groei van een andere niet-fermenterende gramnegatieve staaf werd gezien.
De specificiteit (97,4 procent) van de gecombineerde ChromID-agarplaten (acht platen met groei van Enterobacteriaceae) was significant hoger (p = 0,004) dan de specificiteit (92,8 procent) van de Supercarba-agarplaat (22 platen met groei van Enterobacteriaceae, waarvan op één ook Pseudomonas groeide). De specificiteit van de gecombineerde ChromID-agarplaten was tevens significant (p = 0,0002) hoger dan Supercarba-agarplaten wanneer gekeken werd naar aan- en afwezigheid van groei: 74,9 procent versus 68,4 procent, respectievelijk.
Praktijkervaring
Inmiddels zijn beide agarmethodes (Supercarba-agar en gecombineerde ChromID-agarplaten) ingezet als CPE-kweek bij 585 patiënten, als onderdeel van de BRMO-screening, zie figuur 1. Al deze patiënten zijn in het kader van BRMO-screening ook getest op ESBL. CPE-detectie met een van beide specifieke CPE-agarplaten, of bij ESBL-kweek met bevestiging van CPE met een CIM-test, gold als referentiestandaard voor CPE-kolonisatie. Bij 11 patiënten zijn in totaal 17 CPE-stammen aangetoond. Van de 17 stammen zijn er 11 alleen gedetecteerd in de CPE-kweek en niet in de gelijktijdig ingezette ESBL-kweek; zes van deze stammen hadden wel een ESBL-gen. In negen van de 11 stammen werd hetzelfde species aangetroffen in de ESBL-kweek, maar dan zonder carbapenemase-gen.
Bij vijf patiënten was de CPE-kolonisatie alleen gedetecteerd in de CPE-kweek en niet in de ESBL-kweek; met het ESBL-protocol is dus slechts 54 procent van de CPE-gekoloniseerde patiënten aangetoond. Daarnaast werd bij twee patiënten een tweede CPE-species alleen in de CPE-kweek aangetroffen en niet in de ESBL-kweek. Er zijn geen patiënten geweest bij wie de CPE-kweek negatief was, maar wel een CPE werd aangetroffen in de gelijktijdig ingezette ESBL-kweek.
Bij één patiënt werd de CPE (NDM+ E. coli) alleen gekweekt op de ChromID-agarplaten, niet op de Supercarba-agar. Bij drie patiënten werd de CPE (OXA-48+ E. coli) enkel gekweekt op de Supercarba-agar en bleven de ChromID-agarplaten negatief.
Discussie
Deze studie en praktijkresultaten tonen aan dat ESBL-detectiemethoden onvoldoende geschikt zijn voor CPE-detectie: in 585 kweken werden 11 CPE-kolonisaties gevonden met de CPE-kweekmethodes, terwijl hiervan maar 6 werden aangetoond in de ESBL-kweek. Zowel de Supercarba-agar als de gecombineerde ChromID-agarplaten zijn bruikbaar voor CPE-screening. Voor beide selectieve agars nam de sensitiviteit om bekende CPE-isolaten te detecteren toe met het gebruik van een selectieve ophopingsbouillon. De keuze tussen de beide agars is een afweging tussen sensitiviteit of specificiteit of voor gevoeligheid voor specifieke CPE-genen. De sensitiviteit voor detectie van bekende CPE-stammen na selectieve ophoping was 100 procent op de Supercarba-agar en 92 procent voor de gecombineerde ChromID-agarplaten. De gecombineerde ChromID-agarplaten hadden daarentegen een hogere specificiteit in vergelijking met de Supercarba-agar in de puntprevalentiestudie: 97,4 procent versus 92,8 procent (p = 0,004). Uit de praktijkervaring bleek dat de Supercarba-agar één NDM+ E. Coli-kolonisatie miste, terwijl de ChromID-agar drie OXA-48+ E. Coli-kolonisaties miste.
De sensitiviteit van de Supercarba-agar was vergelijkbaar met de sensitiviteit van 95,6 procent beschreven in Nordmann et al.18 De sensitiviteit zoals beschreven in Girlich et al.17 voor de gecombineerde ChromID-agarplaten (98,2 procent bij inoculum van 105 kve) is hoger dan onze resultaten; mogelijk speelt het hogere inoculum hierbij een rol. Er zijn geen studies die specificiteit van de platen beoordelen in klinische samples.
De hogere sensitiviteit bij gebruik van een ophopingsbouillon is vergelijkbaar met resultaten van Murk et al.20, waarbij hogere sensitiviteit bij het gebruik van bouillon ten opzichte van directe inoculatie werd aangetoond bij selectieve kweek van ESBL-producerende Enterobacteriaceae.
Een beperking bij het uitvoeren van deze en andere studies is het gebrek aan een gouden standaard voor CPE-testen; detectie op een van de CPE-platen of (voor de praktijkervaring) in een ESBL-kweek met positieve CIM-test, is daarom gebruikt als referentie. In deze studie is de sensitiviteit bepaald met bekende isolaten, voor klinische relevantie zou de sensitiviteit idealiter worden bepaald door te testen op rectale swabs. Dit is echter bemoeilijkt door de lage prevalentie van CPE en de afwezigheid van een gouden standaard.
Omdat ophoping de sensitiviteit verhoogde van detectie van bekende CPE-isolaten, is deze stap ingevoerd in de routinediagnostiek. De diagnostische testen zijn niet uitgevoerd zonder ophoping; hierdoor was het helaas niet mogelijk de verwachte toegevoegde positieve waarde van ophoping in de praktijk te bevestigen. Ook het spiken van fecesmonsters met bekende concentraties inocula zou interessant zijn om kwantitatieve analyses te kunnen doen en de detectielimiet te bepalen.
Vanzelfsprekend zijn de selectieve agarplaten niet geschikt voor het screenen op carbapenemase-producerende Pseudomonas spp.21 Pseudomonas spp. zijn gedetecteerd in 58 (19 procent) van de CPE-screeningkweken, en geen van deze produceerden carbapenemase. De specificiteit is daarmee onvoldoende om de methode te gebruiken als screeningsmethode voor carbapenemase-producerende Pseudomonas spp.
De inbedding van de CPE-testen in bestaande laboratoriumprocedures is relatief eenvoudig: de CPE-kweek is qua opzet en doorlooptijd vergelijkbaar met de ESBL-kweek. Er wordt gebruik gemaakt van dezelfde swab die gebruikt wordt bij de ESBL-kweek, waardoor de logistieke aanpassingen en patiëntbelasting minimaal zijn. Het inzetten en uitwerken van extra testen gaat vanzelfsprekend wel gemoeid met meer kosten. In onze studie bleek geen van de gegroeide non-fermentors carbapenemase te produceren. Desondanks valt het te overwegen om bij deze stammen een beperkte screening op carbapenemase te verrichten, bijvoorbeeld via een CIM-test.
Samenvattend is een ophopingstap met bouillon vóór inoculatie van selectieve agarplaten aan te raden voor optimalisatie van de sensitiviteit in het screenen naar CPE-kolonisatie in patiënten. Daarnaast zorgt het gebruik van een CPE-selectieve kweek voor substantieel betere detectie van CPE-kolonisatie dan gebruik van een ESBL-kweek alleen.