Samenvatting
Rotavirus is de belangrijkste oorzaak van acute gastro-enteritis bij kinderen; de ziektelast is hoog, vooral vanwege dehydratie, en het betreft vaak zuigelingen. In Nederland is het rotavirus verantwoordelijk voor 1900 tot 3400 ziekenhuisopnames per jaar en vijf tot zes doden. Kinderen met een medische risicofactor (prematuriteit, laag geboortegewicht of congenitale aandoeningen) hebben een verhoogd risico op ernstige complicaties als gevolg van rotavirusgastro-enteritis.
Sinds 2006 zijn er werkzame, levend verzwakte orale vaccins beschikbaar voor zuigelingen, RotaTeq en Rotarix, die het risico op ernstige rotavirusgastro-enteritis tot meer dan 80 procent verminderen. De vaccins worden over het algemeen goed verdragen. Er is echter een associatie met een klein verhoogd risico op invaginatie, vooral in de eerste zeven dagen na de eerste dosis. De WHO adviseert desondanks universele vaccinatie tegen het rotavirus voor zuigelingen, vanwege de gunstige risico-batenverhouding van vaccinatie. In Nederland is er tot op heden geen rotavirusvaccinatieprogramma. De Gezondheidsraad heeft in september 2017 wel een advies uitgebracht waarin zij positief zijn ten opzichte van universele vaccinatie en het rotavirusvaccin in ieder geval aanraden voor kinderen met een medische risicofactor. Op dit moment wordt deze risicogroepstrategie uitgetest in het Risk group Infant Vaccination Against Rotavirus (RIVAR)-project. Zuigelingen met een dergelijke risicofactor in dertien deelnemende Nederlandse ziekenhuizen krijgen het rotavirusvaccin aangeboden.
Summary
Rotavirus is the most important cause of acute dehydrating gastroenteritis in children; it has a high burden of disease globally affecting mostly young infants. In the Netherlands, rotavirus is responsible for 1900 to 3400 hospitalizations annually among children and five or six cases of pediatric death. Infants with a medical risk condition (i.e. prematurity, low birth weight or severe congenital pathology) are at increased risk of severe and complicated rotavirus gastroenteritis. Since 2006 there are effective, oral live-attenuated vaccines available for infants, RotaTeq and Rotarix, that reduce the risk of severe rotavirus gastroenteritis by more than 80 percent. The vaccines are generally well tolerated, but are associated with a small, but increased risk of intussusception, mainly in the first seven days following the first dose. The WHO however recommends routine rotavirus vaccination for all infants globally given the favourable risk-benefit ratio of vaccination. In the Netherlands a rotavirus vaccination program has not yet been implemented, but in September 2017 the Dutch Health Counsel issued an advisory statement recommending rotavirus immunization for infants with medical risk conditions; the Council is positive towards universal vaccination strategies. Currently this immunization strategy is piloted in the Risk group Infant Vaccination Against Rotavirus (RIVAR) project where a medical risk infants in thirteen participating Dutch hospitals receive routine rotavirus immunization.
Relevantie
Rotavirus is de meest voorkomende oorzaak van acute gastro-enteritis bij kinderen.1 Wereldwijd is het verantwoordelijk voor 40 procent van de ziekenhuisopnames en 450.000 doden per jaar onder kinderen.2 Het rotavirus werd voor het eerst beschreven in 1973 nadat er duodenumbiopsie was verricht bij kinderen met acute diarree. Het dankt zijn naam aan de wielvormige structuur die in het Latijn ‘rota’ wordt genoemd. Dit artikel beschrijft de pathofysiologie, immuunrespons en preventie van rotavirus.
Pathofysiologie
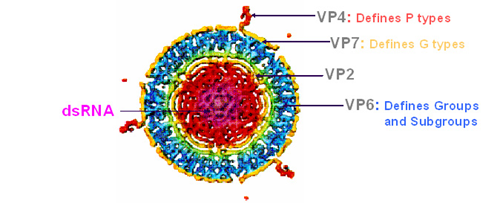
Rotavirussen zijn dubbelstrengs RNA-virussen met een complexe architectuur van drie kapsels om een genoom van 11 segmenten (zie figuur 1). Het genoom codeert voor zes structurele eiwitten (viral protein, VP1,2,3,4,6,7) en zes niet-structurele eiwitten (nonstructural protein, NSP1-6). Op basis van VP6 is het rotavirus op te delen in tien verschillende groepen, aangeduid als groep A tot en met J. De groep A-rotavirussen zijn belangrijke humane pathogenen.3
Rotavirussen zijn voorts onderverdeeld in genotypes op basis van VP7 (glyco-eiwit G) en VP4 (protease splitsend eiwit P, zie figuur 1).3,4 Tot nu toe zijn er 32 G- en 47 P-varianten geïdentificeerd. Zes rotavirusgenotypes vertegenwoordigen samen meer dan 90 procent van de circulerende species: G1P[8], G2P[4], G3P[8], G4P[8], G9P[8] en G12P[8].5 Het G1P[8]-genotype is wereldwijd het meest voorkomend.
Het rotavirus wordt vooral via de fecale-orale route doorgegeven. De virusdichtheid in de ontlasting van geïnfecteerde personen is extreem hoog, tot 1010 viruspartikels per gram ontlasting.6 Honderd partikels zijn al voldoende om een infectie te veroorzaken in een vatbare gastheer.5 Besmette objecten dragen bij aan de hoge transmissie; op handen behoudt het virus enkele uren zijn infectiviteit en op anorganisch materiaal tot wel 60 dagen.
Eenmaal besmet, infecteert en repliceert het rotavirus in de enterocyten en in de entero-endocriene cellen van de dunne darm.5,7 Voor binding aan de enterocyten gebruikt het virus glycanen op het celoppervlak die onderdeel zijn van het histobloedgroepantigenen (HBGAs-)complex.5,8 Het HBGA-fenotype van de gastheer bepaalt deels in welke mate rotavirusgenotypes kunnen binden aan de enterocyt. De diversiteit in HBGA-fenotypes tussen populaties wereldwijd kan een deel van de geografische verschillen in de dominantie van rotavirusgenotypes verklaren.8
Klinische symptomen
De incubatietijd van het rotavirus is kort, minder dan 48 uur. Het ziektebeeld varieert van asymptomatisch tot ernstige dehydratie op basis van diarree, braken en koorts.
Er zijn twee mechanismen die het ontstaan van bovenstaande klachten verklaren. Enerzijds veroorzaakt het rotavirus osmotische diarree als gevolg van celschade, necrose van enterocyten of villusatrofie en dientengevolge malabsorptie. Anderzijds veroorzaakt NSP4, een van de non-structurele eiwitten van rotavirus, secretoire diarree en activatie van het intestinale zenuwstelsel.5
Een rotavirusinfectie leidt tot koorts en malaise door middel van pro-inflammatoire cytokinen, interleukine-1B (IL-1B), tumornecrosefactor (TNF) en IL-6. Het exacte mechanisme hierachter is nog niet verklaard.5 Daarnaast kan het rotavirus een systemische infectie geven, rotavirus-RNA is aangetoond in de lever, het hart, de blaas, de longen, de nieren, testikels en het centraal zenuwstelsel.9
Immuunrespons
Serum en mucosale antilichamen tegen VP7 en VP4 vormen de belangrijkste bescherming tegen ziekte. Neutraliserende antistoffen beschermen zowel tegen homotypische (tegen hetzelfde virustype) als heterotypische (tegen verschillende virustypen) rotavirusgenotypes. De heterotypische bescherming, ook wel cross-protectie genoemd, neemt toe met herhaalde rotavirusinfectie. De rol van celgemedieerde immuniteit is nog deels onopgehelderd, maar virusspecifieke CD8+-cellen spelen waarschijnlijk een rol in de klaring van infectie en bescherming tegen ziekte.5,10
Rotavirusimmuniteit beschermt in hoge mate tegen ernstige symptomen, maar in veel mindere mate tegen infectie. Re-infecties met het rotavirus komen dan ook veelvuldig voor en verhogen de immuniteit tegen het virus.11 Een geleidelijke afname van de CD4+-cellen en neutraliserende antilichamen in de tijd kan mogelijk verklaren waarom er geen definitieve immuniteit tegen re-infectie is.3,7
Epidemiologie en ziektelast
Kinderen raken veelal voor het eerst geïnfecteerd als ze tussen 4 en 23 maanden oud zijn.5 Symptomen en ernstige ziekte komen het frequentst voor bij de eerste infectie. Op deze leeftijd is dan de piek van ziekenhuisopname als gevolg van rotavirusgastro-enteritis. Eerder onderzoek heeft aangetoond dat in Nederland het rotavirus verantwoordelijk is voor 56 procent van pediatrische opnames voor virale gastro-enteritis.12 Prematuriteit, dysmaturiteit en aanwezigheid van ernstige congenitale aandoeningen vormen risicofactoren voor een ernstiger en gecompliceerder beloop van rotavirusgastro-enteritis.13 Zij vormen daarmee een hoogrisicogroep voor rotavirusinfecties. De in Nederland geobserveerde sterfte door het rotavirus treft vrijwel uitsluitend deze groep.14
Andere risicogroepen voor ernstige rotavirusinfectie zijn immuungecompromitteerde patiënten en ouderen.5,15,16 Circa vijf procent van de diarree-uitbraken in geriatrische instellingen wordt veroorzaakt door het rotavirus.15 Tot 50 procent van ouders ervaren milde tot matige klachten van gastro-enteritis, wanneer hun kind met het rotavirus is geïnfecteerd, hetgeen wijst op een hoge mate van transmissie binnen gezinnen.15
Rotavirus is een sterk seizoensgebonden virus met een piekincidentie tussen januari en april.15,17 Sinds 2014 observeren we in Nederland een nog onverklaarde daling in het aantal rotavirusinfecties.18 In 2014 en 2016 was het aantal detecties van het rotavirus in laboratoria aangesloten bij het nationale virologische surveillancenetwerk bijna 60 procent lager dan in voorgaande jaren. Tijdens de tussenliggende jaren 2015 en 2017 werd een normaal rotavirusseizoen gezien. Mogelijke factoren die dit fenomeen kunnen verklaren zijn de relatief milde winters in deze jaren, de dalende trend in het aantal geboortes per jaar in Nederland en de invoering van algemene rotavirusvaccinatie van zuigelingen in ons omringende landen.19 Dit laatste zou de circulatie van het virus in de omgeving van Nederland dusdanig hebben kunnen verlaagd dat bij ons hiervan ook een effect wordt gezien.
Desondanks zijn er in Nederland jaarlijks naar schatting nog steeds 1900 tot 3400 ziekenhuisopnames onder kinderen als gevolg van rotavirusgastro-enteritis en vijf tot zes sterfgevallen.20
Rotavirusvaccinatie
Gezien de kenmerken van het rotavirus, zoals hierboven beschreven, is eliminatie van het rotavirus niet mogelijk. Hygiëne en sanitaire maatregelen beperken het verspreiden van het rotavirus onvoldoende.5 Vaccinatie tegen het rotavirus is daarom de meest effectieve methode om ziekte te voorkomen.
Op dit moment zijn er twee verschillende vaccins beschikbaar; beide vaccins bevatten levend verzwakt rotavirus en worden oraal toegediend. De vaccins zijn uitsluitend ontwikkeld en onderzocht voor toediening aan zuigelingen. Op dit moment zijn er geen vaccins beschikbaar die zijn geïndiceerd voor andere leeftijdsgroepen.
RotaTeq® (Merck and Co, Inc., Whitehouse station, NJ, USA) is pentavalent en bevat vijf humaan-boviene stammen (G1, G2, G3, G4 en P1A[8]) van rotavirus; het wordt gegeven in drie doseringen. Rotarix® (GlaxoSmithKline Vaccines, Waver, België) bevat één monovalente (G1P8) humane stam en wordt toegediend in twee doses.
De vaccins werken door een natuurlijke rotavirusinfectie na te bootsen. De virusstam in het vaccin infecteert het dunnedarmepitheel en wekt een immuunrespons op die vergelijkbaar is met een natuurlijke rotavirusinfectie. De complete vaccinatie (herhaalde doses) zorgt voor een brede bescherming tegen diverse genotypes en biedt zodoende heterotypsiche immuniteit.21,22 Beide vaccins zijn getest op werkzaamheid en veiligheid in grote internationale klinische trials met in totaal meer dan 150.000 zuigelingen. Werkzaamheid wordt aangetoond in gerandomiseerde, geblindeerde en placebogecontroleerde onderzoeken. De hoogste werkzaamheid werd gemeten in Europa en Noord-Amerika en was 80 tot 100 procent tegen ernstig rotavirusgastro-enteritis veroorzaakt door diverse rotavirusgenotypes.23-27 De werkzaamheid in ontwikkelingslanden bleek echter duidelijk minder, rond 40 tot 70 procent.28,29 Redenen voor verminderde werkzaamheid zijn onder andere maternale antistoftiters, intestinale dysbiose en verschil in gastheerrespons.30,31 Desondanks heeft rotavirusvaccinatie in bijvoorbeeld Mexico geresulteerd in een daling van ruim 50 procent van diarreegerelateerde sterfte onder kinderen.32
Effectiviteitstudies bestuderen de effecten op ziektelast in een real life setting. In Europese landen, waar rotavirusvaccinatie voor zuigelingen is ingevoerd, wordt een afname van het aantal opnames voor rotavirusinfectie van 65 tot 84 procent als effect beschreven.33 Daarnaast geeft algemene rotavirusvaccinatie van zuigelingen zogenaamde herd effecten, waardoor het aantal ziektegevallen onder niet-gevaccineerden eveneens daalt.34-36
Bijwerkingen vaccinatie
De vaccins worden over het algemeen goed verdragen en hebben een mild bijwerkingspatroon, met darmkrampen en enkele dagen dunnere ontlasting als meest voorkomende klachten bij een op de 10 tot 100 gevaccineerden. Rotavirusvaccinatie kent ook een ernstige, maar zeer zeldzame bijwerking; invaginatie. Dit is het plots in elkaar schuiven van de darmen met acute afsluiting tot gevolg. Het gaat gepaard met bloed bij de ontlasting en hevige buikpijn. In ernstige en langdurende gevallen kan het leiden tot necrose van een deel van de darm. Als invaginatie tijdig wordt herkend, kan het zonder chirurgisch ingrijpen worden verholpen. De oorzaak en pathofysiologie van dit spontane ziektebeeld is nog niet begrepen, het mechanisme van vaccinatiegeïnduceerde invaginatie evenmin.
De relatie tussen invaginatie en rotavirusvaccinatie was al bekend voordat de huidige generatie vaccins in 2006 beschikbaar kwam. Een eerder rotavirusvaccin, RotaShield®, werd in de Verenigde Staten ingevoerd en al na één jaar in 1999 weer van de markt gehaald, nadat een associatie met invaginatie werd aangetoond, die in fase III-studies niet was gedetecteerd.37 Het risico werd geschat op 1 op de 10.000 gevaccineerde kinderen. De twee huidige vaccins zijn daarom zeer uitgebreid onderzocht op deze bijwerking.38 Ook de nieuwe generatie vaccins is geassocieerd met invaginatie, zij het in veel mindere mate. Het risico wordt geschat op 1,1 tot 2,7 per 100.000 gevaccineerde kinderen en is voornamelijk aanwezig in de eerste zeven dagen na de eerste dosis.39
De incidentie van spontane invaginatie bij kinderen neemt vanaf een leeftijd van drie maanden sterk toe en piekt rond de zes tot acht maanden.38 Om de kans op invaginatie door vaccinatie te reduceren wordt daarom aangeraden om de eerste dosis vroeg, op de leeftijd van zes tot acht weken toe te dienen en niet later dan 16 weken.
Omdat bij vaccinatie levend verzwakt rotavirus wordt toegediend, komt uitscheiding van de vaccinstam in de ontlasting zeer frequent voor. Studies hebben aangetoond dat uitscheiding bij 50 procent tot 95 procent van de gevaccineerde kinderen optreedt.40-43 Theoretisch is er kans op transmissie van de vaccinstam en besmetting van andere individuen. Ziekte door een rotavirusvaccinstam is tot dusver alleen in één ziektegeval beschreven, waarbij er re-assortment was opgetreden van twee vaccinstammen aanwezig in het pentavalente vaccin RotaTeq.44 Recente rotavirusvaccinatie wordt daarom niet beschouwd als een risico voor de omgeving. Wel wordt geadviseerd om contact met ernstig immuungecompromitteerde patiënten te vermijden.
WHO-advies
De World Health Organisation (WHO) adviseert sinds 2009 om rotavirusvaccinatie op te nemen in alle nationale immunisatieprogramma’s.45 In Nederland is rotavirusvaccinatie tot op heden niet opgenomen in het Rijksvaccinatieprogramma (RVP).

Afgelopen september 2017 heeft de Gezondheidsraad een advies uitgebracht om rotavirusvaccinatie in ieder geval standaard aan te bieden aan kinderen in de risicogroep. Dit betreft ongeveer 8 procent van de pasgeborenen. De Gezondheidsraad staat in haar advies ook positief tegenover het vaccineren van alle kinderen in Nederland, met de kanttekening dat de kosteneffectiviteit van vaccinatie bij de huidige vraagprijzen van de vaccins ongunstig is.20
Onder kinderen met een medische risicofactor zijn studies verricht - zij het op kleine schaal - naar veiligheid en werkzaamheid van de beide vaccins. De resultaten hiervan zijn vergelijkbaar met die van gezonde kinderen wat betreft werkzaamheid (RotaTeq) of immunogeniciteit (Rotarix) en veiligheid.46-48 Effectiviteitsstudies voor rotavirusvaccinatie bij kinderen met een medische risicofactor zijn nog niet op grote schaal verricht.
RIVAR-project
Op dit moment kunnen kinderen met een medische risicofactor (prematuriteit, dysmaturiteit en/of ernstige congenitale aandoening) in het kader van het RIVAR-project immunisatie tegen het rotavirus verkrijgen. RIVAR is een acroniem voor Risk group Infant Vaccination Against Rotavirus. Dit project, waaraan dertien Nederlandse ziekenhuizen deelnemen, is een pilotstudie naar de haalbaarheid en effectiviteit van rotavirusvaccinatie onder deze specifieke patiëntenpopulatie. Sinds mei 2016 is rotavirusvaccinatie geïmplementeerd als nieuwe standaardzorg in de deelnemende ziekenhuizen: Wilhelmina Kinderziekenhuis te Utrecht, Isala klinieken te Zwolle, Maastricht Universitair Medisch Centrum, Sint Antonius Ziekenhuis te Nieuwegein, Máxima Medisch Centrum te Veldhoven, Franciscus Gasthuis & Vlietland te Rotterdam, Maasstad Ziekenhuis te Rotterdam, Spaarne Gasthuis te Hoofddorp en Haarlem, Academisch Medisch Centrum te Amsterdam, Onze Lieve Vrouwe Gasthuis Oost en West te Amsterdam, Rijnstate Ziekenhuis te Arnhem, Deventer Ziekenhuis en Albert Schweitzer ziekenhuis te Dordrecht. De resultaten van het RIVAR-project ten aanzien van vaccineffectiviteit worden in 2020 verwacht.
Met voorlopige data, tot en met april 2018, hebben we de vaccinatiegraad per deelnemend centrum in kaart gebracht. Dit overzicht is gebaseerd op alle in aanmerking komende kinderen die vijf maanden en ouder zijn, voorbij de leeftijdsgrens voor vaccinatie tegen rotavirus. Aangezien de datacollectie nog niet compleet is, zijn er nog ontbrekende vaccinatiegegevens. De vaccinatiegraad is gemiddeld rond de 60 procent en wisselend per centrum, tussen 39 en 81 procent. Vooral de academische ziekenhuizen hebben een lagere vaccinatiegraad, vaak door overplaatsing naar niet aan RIVAR deelnemende ziekenhuizen. Andere redenen voor deze suboptimale vaccinatiegraad zijn: het theoretische risico op verspreiding van de virusstam in het vaccin, kinderen die tot voorbij de leeftijd van 14 weken zijn opgenomen of kritisch ziek zijn, en/of het rotavirusvaccin wordt niet besproken met ouders.
Toekomst
Naast de twee besproken vaccins zijn er nog vier vaccins met uitsluitend een lokale licentie in specifieke landen buiten Europa. Deze vier zijn alle orale levend verzwakte vaccins. De werkzaamheid varieert tussen 56 en 78 procent. Daarnaast zijn er nieuwe, veelbelovende vaccins in diverse stadia van ontwikkeling en klinische testen. Momenteel is een neonataal vaccin vergevorderd in een fase III-trial. Dit quadrivalente vaccin RV3-BB is in Australië ontwikkeld uit een neonatale virusstam. De eerste dosis van dit vaccin wordt neonataal (binnen zes dagen na geboorte) toegediend en beoogt daarmee extra bescherming te bieden aan kinderen jonger dan drie maanden.49
Daarnaast zijn er parenterale rotavirusvaccins in ontwikkeling. Deze maken gebruik van zogeheten virus-like particles.50-52 Voordelen van deze vaccins zijn de afwezigheid van virale uitscheiding en de gunstigere bewaarcondities, waardoor de noodzaak van gekoeld bewaren vervalt. Vooral voor ontwikkelingslanden is dit een belangrijk voordeel. Eén kandidaatvaccin daarvoor, het P2-VP8-vaccin, heeft al veelbelovende resultaten in fase I/II-trials laten zien na intramusculaire toediening bij volwassenen.49
De minister van Volksgezondheid zal naar aanleiding van het advies van de Gezondheidsraad een besluit nemen over de in te voeren rotavirusvaccinatiestrategie. Drie alternatieven worden momenteel onderzocht:
- algemene zuigelingenvaccinatie via het RVP;
- vaccinatie van alleen risicogroepen via het RVP, gefinancierd vanuit overheidsfinanciën (zoals Hepatitis B-vaccinatie voor kinderen van HBsAg-positieve moeders tot 2011);53
- opname van vaccinatie in het basispakket voor zuigelingen met een medische risicofactor, vergoeding via het basispakket (zoals RS-vaccinatie).54
Op grond van de voorlopige RIVAR-gegevens adviseren we een universele vaccinatiestrategie. De vaccinatiegraad blijft laag met behulp van een risicogroepaanpak en zo wordt onvoldoende protectie op populatieniveau bereikt. Juist de extra kwetsbare zuigelingen lopen op die manier een ongewijzigd risico op infectie met het rotavirus en de complicaties ervan.
Totdat er een landelijk beleid is kunnen kinderen uit de risicogroep, die zorg ontvangen in een aan RIVAR-deelnemend ziekenhuis, rotavirusvaccinatie kosteloos verkrijgen. Voor overige zuigelingen kan rotavirusvaccinatie op recept via de (huis)arts worden verkregen. De kosten hiervan bedragen circa 135 euro en worden niet vergoed.