Samenvatting
De incidentie van neonatale herpessimplexvirus (HSV)-infecties in Nederland is laag, maar neemt de laatste jaren toe. Naast de milde vorm beperkt tot enkele huidblaasjes, kan dit ziektebeeld uitbreiden tot een neurologische of gedissemineerde variant met een hoge mortaliteit en morbiditeit. Een klinische diagnose wordt bemoeilijkt door een vaak aspecifieke presentatie en overlap in verschillende uitingsvormen. Tijdige herkenning en inzetten van diagnostiek en therapie is cruciaal voor een gunstige uitkomst. Dit artikel geeft een overzicht van de epidemiologie, kliniek, diagnostiek en behandeling van neonatale HSV-infecties.
Abstract
Neonatal herpes simplex virus (HSV) infections are rare in the Netherlands, yet the incidence is increasing. The course of disease can range from a local infection of the skin and conjunctivae to neurological or disseminated disease characterized by a high morbidity and mortality rate. As the clinical presentations are often nonspecific in neonatal HSV infections and outcomes can be very unfavourable in untreated patients, prompt and adequate diagnostic testing and therapeutic interventions are crucial. This article provides an overview of the epidemiology, clinical symptoms, diagnostic tools and therapeutic interventions in neonatal HSV infections.
Inleiding
Herpessimplexvirus (HSV) type 1 en 2 zijn dubbelstrengs DNA-virussen die behoren tot de herpesviridaefamilie, waartoe ook het varicellazostervirus, epstein-barrvirus en cytomegalovirus behoren. Een aantal bekende ziektebeelden wordt door dit virus veroorzaakt, zoals herpes labialis (meestal veroorzaakt door HSV-1) of genitalis (meestal door HSV-2). Besmetting vindt plaats door direct contact met oraal, genitaal of conjunctivaal slijmvlies. Na een primaire infectie verblijft het HSV latent in de sensibele of autonome ganglia. Hieruit ontstaan periodieke (sub)klinische reactivaties, die zich meestal levenslang manifesteren.1 Een primaire HSV-infectie wordt doorgaans opgelopen op de kleuterleeftijd en verloopt in 85 tot 95 procent van de gevallen asymptomatisch. Een neonatale HSV-infectie, of herpes neonatorum, wordt gedefinieerd als een infectie met HSV in de eerste 28 levensdagen van een pasgeborene. De ernst van een herpes neonatorum kan variëren van mild tot zeer ernstig met een fulminant beloop en fatale afloop. Beide HSV-typen kunnen een neonatale infectie veroorzaken en infecties kunnen het gevolg zijn van een maternale primaire infectie of van een reactivatie.
Epidemiologie
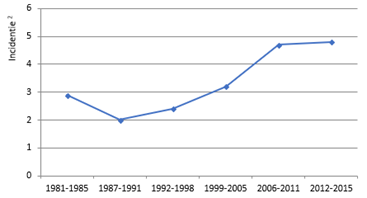
HSV-dragerschap is zeer prevalent; studies onder de Nederlandse bevolking rapporteren een HSV-1-seroprevalentie van 61 tot 75 procent en van 11 tot 27 procent voor HSV-2.2,3 HSV-infecties bij neonaten zijn echter zeldzaam. Sinds 1981 zijn er periodieke monitorstudies verricht in Nederland waardoor de incidentie van neonatale HSV-infecties goed in kaart is gebracht. De meest recent gerapporteerde incidentie bedraagt 4,8 per 100.000 neonaten.4 In de afgelopen 15 jaar is de incidentie van neonatale HSV-infecties toegenomen (zie figuur 1).4-9 Een mogelijke verklaring voor deze toename zou de implementatie van de gevoelige polymerase chain reaction (PCR)-test in de diagnostiek kunnen zijn.
De leeftijd waarop een primaire HSV of HSV primo-infectie wordt opgelopen, lijkt toe te nemen.10 Primaire expositie aan HSV op een volwassen leeftijd kan problematisch zijn voor vrouwen in de vruchtbare leeftijd. In een studie naar genitale HSV werd de incidentie van neonatale HSV-infecties vergeleken onder kinderen van vrouwen met verschillende serologische status op moment van bevalling.11 De kans op transmissie bleek aanzienlijk groter bij vrouwen die een primo-infectie doormaakten rondom de partus vergeleken met een HSV-reactivatie (adjusted OR 59,3). In het eerste geval zijn er tijdens de zwangerschap nog geen maternale IgG-antistoffen tegen HSV aanwezig om transplacentair aan de foetus over te dragen.
Transmissie
Er worden drie momenten van transmissie onderscheiden: intra-uterien (in de zwangerschap), perinataal (rond de geboorte) en postnataal (na de geboorte). Intra-uteriene transmissie komt zelden voor. Perinatale transmissie door direct contact met vaginaal secreet durante partu of ascenderend bij langdurig gebroken vliezen is de meest voorkomende route (85 procent).12 De kans op verticale transmissie via moeders met een primo-infectie vlak voor de partus is significant groter dan vroeger in de zwangerschap. Hierbij hoeft er geen sprake te zijn van een symptomatische infectie.1 Mathematische modellen suggereren een lage kans op transmissie van HSV naar een seksuele partner bij een genitale virale lading (VL) van minder dan 4 log10 en een hoge kans bij VL meer dan 6 log10.13 Het is onduidelijk in hoeverre de hoogte van de maternale VL een rol speelt in verticale transmissie, hoewel het aannemelijk is dat de VL bij een primo-infectie hoger is dan bij een reactivatie.1
Bij postnatale transmissie (10 procent van de gevallen) kan overdracht plaatsvinden door direct contact met familie of verzorgers die HSV uitscheiden vanuit een orale herpesinfectie, een cutane laesie of asymptomatische infectie. Hierbij is het risico lager indien het een kind betreft van een moeder met een recidiverende herpesinfectie, gezien de waarschijnlijke overdracht van beschermende maternale antistoffen.
Kliniek
Een herpes neonatorum kent drie verschillende klinische uitingsvormen: mucocutane, neurologische en gedissemineerde ziekte. Mucocutane ziekte kenmerkt zich door een beperkte infectie van huid en slijmvliezen met een doorgaans gunstige prognose. Een orale herpesinfectie presenteert zich met enkele geclusterde pijnlijke vesiculaire laesies op mond, palatum of tong. Bij een HSV-keratoconjunctivitis ontstaan periorbitale laesies en conjunctivale roodheid. Hierbij kan blijvend visusverlies optreden indien een keratoconjunctivitis vaak recidiveert en/of chronisch wordt.
Door retrograde verspreiding van HSV via perifere zenuwen of secundair ten gevolge van een viremie kan neurologische ziekte ontstaan. Doorgaans worden de eerste symptomen rond de 17e levensdag beschreven. In de kliniek ziet men koorts in combinatie met neurologische symptomen zoals insulten, meningeale prikkeling en lethargie. De neurologische variant, of HSV meningo-encefalitis, kent een mortaliteit van meer dan 50 procent die verbetert tot 6 procent bij adequate therapie.14 Door destructieve laesies in de cortex zijn neurologische restverschijnselen veelvoorkomend: slechts 35 procent van de overlevenden heeft een normale neurocognitieve ontwikkeling.15,16
De gedissemineerde HSV-infectie is ook een ernstig ziektebeeld dat gelijkenis vertoont met een bacteriële sepsis. Hierbij zijn meerdere organen aangedaan, waaronder vaak lever en longen. Gedissemineerde ziekte presenteert zich meestal in de eerste week postpartum met aspecifieke symptomen zoals hyper- of hypothermie, prikkelbaarheid en verminderde intake. Bij lichamelijk onderzoek kunnen tachypneu, hepatomegalie, ascites, icterus en petechiën opvallen. Een mortaliteit van 80 procent wordt beschreven, die ondanks behandeling rond de 29 procent blijft.17
Het stellen van een klinische diagnose wordt bemoeilijkt door de vaak aspecifieke presentatie.18-20 Slechts 40 tot 50 procent van de patiënten presenteert zich met koorts en de typerende herpetische huidlaesies zijn afwezig in 60 procent van de gevallen. Bij de helft van de neonaten met HSV-meningo-encefalitis kunnen neurologische symptomen ontbreken bij initiële opvang. Er wordt dikwijls overlap van de verschillende uitingsvormen gezien. Bij een ogenschijnlijk gelokaliseerde herpes neonatorum moet men bedacht zijn op neurologische of gedissemineerde uitbreiding van infectie met het oog op de verschillende behandeling en prognose.
Diagnostiek
Aanvankelijk was de virale kweek de gouden standaard voor het diagnosticeren van herpes neonatorum. Tegenwoordig is de PCR-test de belangrijkste diagnostische methode. Serologie heeft geen plek in de diagnostiek wegens de transplacentaire overdracht van maternale IgG-antistoffen en een IgM-respons die doorgaans pas na de vijfde levensdag meetbaar is bij neonaten.12
PCR-test
In de afgelopen 15 jaar heeft de PCR-test een belangrijke rol gekregen in de diagnostiek naar HSV. Hierbij wordt HSV-DNA geamplificeerd tot het detecteerbaar wordt middels PCR. Deze efficiënte techniek is mogelijk op plasma, liquor, blaasjesvocht, traanvocht, urine, oog-, huid- en orofarynxuitstrijken en geeft resultaat binnen twee dagen. In eerdere studies naar de toepassing van PCR op liquor bij neonaten met HSV-meningo-encefalitis werd een sensitiviteit van 74 tot 76 procent gerapporteerd.21,22 In een recente cohortstudie van 63 neonaten met een HSV-infectie werd de diagnostische waarde van PCR op liquor en plasma onderzocht.15 Van PCR op liquor werd een sensitiviteit beschreven van 72 procent en PCR op plasma was positief in 83 procent van alle gevallen. Daar de sensitiviteit van diagnostiek toeneemt, dient dus altijd bij verdenking op herpes neonatorum een PCR op plasma te worden verricht.
De diagnose van mucocutane ziekte wordt gesteld op basis van cutane of oculaire laesies én een positieve PCR of kweek op uitstrijken van huid, blaasvocht, conjunctiva of plasma. Een positieve PCR of kweek op liquor ongeacht neurologische symptomen óf evidente neurologische symptomen/liquorafwijkingen met een positieve PCR of kweek in plasma of huiduitstrijk bevestigt de diagnose HSV-meningo-encefalitis. In de liquor kunnen mononucleaire pleiocytose, lage tot normale glucoseconcentratie en een licht verhoogd proteïne worden gezien. Klinische tekenen van multiorgaanbetrokkenheid (respiratoire insufficiëntie, ascites, verhoogde levertransaminasen, diffuse intravasale stolling) met een positieve PCR of kweek van plasma, liquor of huiduitstrijken zijn een bewijs voor gedissemineerde ziekte. Aangezien het onderscheid tussen de drie ziektebeelden niet uitsluitend te maken is op basis van kliniek en de grenzen mogelijk niet zo evident zijn, dient men bij een verdenking op herpes neonatorum altijd de aanwezige laesies, plasma én liquor te onderzoeken op HSV.
Uit kwantitatieve analyses bleek de gemiddelde VL significant hoger bij neonaten met gedissemineerde ziekte vergeleken met de mucocutane en neurologische variant.15,23 Verder bleek de gemiddelde VL gecorreleerd met mortaliteit, maar niet met neurologische verschijnselen. In oudere studies werd een hogere morbiditeit bij follow-up beschreven in de groep met een HSV-positieve liquoruitslag na beëindiging van aciclovir-therapie.21,22 Er zijn echter meer systematische onderzoeken nodig naar het kwantitatieve gebruik van PCR om therapierespons te beoordelen. De richtlijn van de Stichting Werkgroep Antibiotica Beleid en het Erasmus MC adviseert minstens éénmaal klaring van het virus in de liquor aan te tonen met PCR voor het staken van aciclovir.24
Contaminatie van uitstrijken in het laboratorium of de aanwezigheid van bloed in de liquor na een traumatische punctie kunnen leiden tot foute testuitslagen. Er moet ook rekening worden gehouden met contaminatie vanuit het baringskanaal, waardoor uitstrijken van huid, conjunctivae en orofarynx tot 24 à 48 uur postpartum nog positief kunnen zijn zonder dat er sprake is van een infectie. Overigens kan betrokkenheid van de meningen nog ontbreken in de initiële fase van een neurologische infectie waardoor de PCR aanvankelijk een negatieve uitslag geeft.25 Indien de eerste lumbaalpunctie binnen 72 uur na begin van klachten negatief is en er een verdenking op een HSV-meningo-encefalitis bestaat, dient deze te worden herhaald in de eerste week van ziekte.
Behandeling
Hoge dosering intraveneus aciclovir (60mg/kg/dag in drie doses) gedurende 21 dagen is de eerstekeuzebehandeling voor neurologische en gedissemineerde herpes neonatorum. In verscheidene trials is de effectiviteit van dit regime superieur gebleken ten opzichte van lagere doseringsschema’s en het eerder toegepaste middel vidarabine.14,26 Bij mucocutane ziekte volstaat 14 dagen, mits neurologische betrokkenheid is uitgesloten. Het tijdig starten van aciclovir-therapie (binnen 24 uur na opname) verbetert de overlevingskans aanzienlijk.27 In tegenstelling tot antibiotische behandeling kan aciclovir direct worden gestart en hoeft men niet te wachten tot liquor is afgenomen voor PCR. De detecteerbare lading in liquor neemt namelijk nog toe onder aciclovir tot circa dag vijf van behandeling, mogelijk door de toename van HSV-DNA ‘afbraakproducten’.28 Bekende bijwerkingen van aciclovir zijn neutropenie en nefrotoxiciteit; spontaan herstel wordt echter vrijwel altijd beschreven. Volledig bloedbeeld, neutrofielen, lever- en nierfunctie dienen regelmatig te worden gecontroleerd.
Onlangs is het gebruik van suppressieve therapie middels orale (val)aciclovir gedurende zes maanden toegevoegd aan de behandeling van neurologische en gedissemineerde ziekte in de LCI-richtlijn van het RIVM.29 Suppressieve therapie geeft een significante verbetering in neurocognitieve ontwikkeling bij neonaten met neurologische betrokkenheid en verlaagt het aantal cutane recidieven.16,30 Desondanks werden ernstige restverschijnselen na een jaar alsnog beschreven in een aanzienlijk deel (19 procent) van de behandelde groep.
De geregeld aspecifieke klinische presentatie in combinatie met de lage incidentie maakt een al dan niet empirische benadering van dit ziektebeeld nog steeds een punt van internationale discussie. Het empirisch starten van aciclovir bij een verdenking op een herpes neonatorum is een afweging van de voor- en nadelen van over- en onderbehandeling. Uiteraard dient altijd de klinische context van de patiënt te worden meegewogen bij de interpretatie van een PCR-uitslag en dient deze in geval van twijfel te worden herhaald.
Preventie
In de richtlijn Seksueel overdraagbare aandoeningen in de 2e lijn (2018) zijn preventieve maatregelen in geval van een verdenking op maternale HSV-infectie beschreven.31 Middels serologisch onderzoek moet onderscheid worden gemaakt tussen een primo-infectie of reactivatie. Indien er een primo-infectie optreedt na een amenorroeduur van 34 weken wordt een sectio caesarea aanbevolen. Voor 34 weken of in geval van een reactivatie kan een vaginale baring plaatsvinden, waarbij andere risicofactoren voor transmissie - zoals langdurig gebroken vliezen en invasieve monitoring (bijvoorbeeld een schedelelektrode) - moeten worden vermeden. Bij de neonaat dient men 24 tot 48 uur postpartum uitstrijken voor HSV-PCR af te nemen van orofarynx en conjunctivae.
Conclusie
Neonatale HSV-infecties zijn relatief zeldzaam, maar gaan gepaard met een hoge morbiditeit en mortaliteit. Het hoogste risico op transmissie en ziekte bestaat bij perinatale besmetting van het kind als gevolg van een primaire herpes genitalis van moeder vlak voor of tijdens de partus. Ondanks de beschikbaarheid van een valide diagnosticum en effectieve therapie blijft de snelheid van diagnostiek en behandeling een uitdaging, gezien de vaak aspecifieke presentatie. Indien er een verdenking op herpes neonatorum bestaat, is het gezien de milde bijwerkingen van aciclovir te verantwoorden om tot diagnostiek en empirische therapie met aciclovir te besluiten. Neurologische betrokkenheid is niet uit te sluiten op basis van kliniek en dient altijd te worden onderzocht via aanvullend onderzoek.