Samenvatting
Alle positieve Mycobacterium tuberculosis-kweken in Nederland worden bij het RIVM onderworpen aan een epidemiologische typering, waarbij het verkregen DNA-profiel karakteristiek is voor de respectievelijke stam. Indien meerdere kweken van een inzendend laboratorium die binnen een week zijn ingezet, identieke DNA-profielen hebben, is dit een waardevolle voorspeller van een foutpositieve kweek. Dit artikel beschrijft de procedure die wordt gebruikt om te onderzoeken of er inderdaad sprake is van een foutpositieve kweek, omdat dit belangrijke consequenties heeft voor de betrokken patiënt en de behandelaar.
Summary
All positive Mycobacterium tuberculosis cultures in the Netherlands are subjected to epidemiological typing at the RIVM. The DNA profiles obtained are characteristic of the respective strain. If there are multiple cultures from a submitting laboratory that have been processed in the same week and reveal identical DNA profiles, this is a valuable indication of a false positive culture. This article describes the procedure used to investigate whether indeed a false positive culture occurred, as this has important consequences for the patient involved as well as the practitioner.
Inleiding
Al snel na de introductie van DNA-fingerprinting van Mycobacterium tuberculosis complex-isolaten in Nederland (in 1993) bleek dat deze epidemiologische typering ook bruikbaar is voor het opsporen van mogelijk foutpositieve kweken. Sinds 2009 (met terugwerkende kracht tot 2004) wordt de 24-loci-VNTR-typering door het RIVM structureel toegepast op alle positieve M. tuberculosis complex-kweken die in Nederland worden verkregen. In dit artikel wordt de werkwijze beschreven die het tuberculosereferentie-laboratorium van het RIVM hanteert bij het vinden van vermoedelijke laboratorium-kruiscontaminaties (LKC’s). Daarnaast wordt de trend in de detectie van LKC’s in de afgelopen jaren beschreven evenals drie interessante casus.
Vanwege het belang van de nationale tuberculosesurveillance en het monitoren van tuberculosetransmissie adviseert de richtlijn van de Nederlandse Vereniging voor Medische Microbiologie (NVMM) voor mycobacteriële laboratoriumdiagnostiek (2015) om alle positieve M. tuberculosis complex-kweken op te sturen naar het RIVM voor een moleculaire typering. In de meeste gevallen worden tegelijkertijd de (noodzakelijke) identificatie en resistentiebepaling aangevraagd. Hoewel moleculaire technieken in toenemende mate worden gebruikt om M. tuberculosis complex aan te tonen in patiëntmateriaal, blijven positieve kweken vooralsnog belangrijk voor het bevestigen van de diagnose ‘tuberculose’, maar ook voor fenotypische resistentiebepalingen en epidemiologische typering. Bij DNA-fingerprinting wordt een profiel geproduceerd dat karakteristiek is voor een M. tuberculosis complex-stam, waardoor verspreiding van tuberculose gericht kan worden onderzocht. De resultaten van deze typering worden systematisch gebruikt in het epidemiologisch onderzoek van de GGD’s om transmissie vanuit ‘open tuberculosegevallen’ te onderzoeken. Ze zijn daarnaast relevant voor het signaleren van vermoedelijke LKC’s.
Wat is een laboratorium-kruiscontaminatie?
Tijdens (menselijke) handelingen binnen en buiten het laboratorium, zoals de bewerking van materiaal tijdens het inzetten van een kweek, kan een klinisch monster door allerlei oorzaken worden gecontamineerd met mycobacteriën. Dit kan een foutpositieve kweek tot gevolg hebben, meestal aangeduid als een laboratoriumkruiscontaminatie (LKC). Hoewel foutpositieve kweken meestal zijn te herleiden naar foutieve handelingen in het laboratorium, kunnen er ook contaminaties en verwisselingen optreden tijdens het afnemen en verwerken van klinische materialen. Een bekend voorbeeld hiervan is een niet-functionerende decontaminatie van bronchoscopen1,2,3,4 of de verwisseling van patiëntmaterialen bij afname.
Een overzicht van bekende risicofactoren voor het optreden van een foutpositief kweekresultaat door een LKC en indicaties hiervoor is weergegeven in tabel 1. Men dient zich hierbij te realiseren dat M. tuberculosis complex-bacteriën zeer goed bestand zijn tegen omgevingsfactoren, waardoor zij lang kunnen overleven in allerlei vloeistoffen en in de laboratoriumruimte.5
Hierna volgt een overzicht van risicofactoren en indicaties voor het optreden van een foutpositief kweekresultaat.6
Bekende risicofactoren voor LKC’s
- een beperkt aantal monsters (< 3000/jaar)
- foutief labelen/stickeren van patiëntmateriaal
- batchgewijs aannemen en inzetten van materialen
- gebruik van vloeibare media
- luchtstroomverstoring door teveel materiaal in het bioveiligheidscabinet (BVC)
- onvoldoende reinigen en desinfecteren van BVC’s
- langdurig gebruik van grote volumes van bijv. buffers
- gebruik van een stam als positieve controle in de kweek
Indicaties voor LKC
- identieke DNA-fingerprints onder kweken die binnen 7 dagen in het laboratorium positief worden bevonden
- positief kweekresultaat zonder passend klinisch beeld
- alleen positieve moleculaire test, of auramine, of kweek, waarbij de overige twee testen negatief blijven
- enkelvoudige positieve kweek
- uitsluitend groei in vloeibaar medium of op vast medium
- groei van < 5 kolonies op vast medium
- het snel (< 10 dagen) positief worden van een kweek bij negatieve auramine en/of PCR
Werkwijze bij de detectie van een laboratoriumkruiscontaminatie
Indien er bij de structurele toepassing van DNA-fingerprinting op alle positieve M. tuberculosis complex-kweken stammen worden gevonden die een identieke DNA-fingerprint hebben en die binnen zeven dagen zijn ingezet bij een regionaal of perifeer laboratorium, wordt dit aangeduid als een ‘vermoedelijke LKC’. Het tuberculose-referentielaboratorium bij het RIVM informeert dan direct de arts-microbioloog van het inzendende laboratorium schriftelijk, waarbij de vraag wordt gesteld of de kweek mogelijk door een kruiscontaminatie positief geworden kan zijn. Tevens wordt geadviseerd om een kweek van dezelfde patiënt, maar van een andere inzetdatum in te sturen, zodat het RIVM de VNTR-typering kan herhalen. In de praktijk is een andere kweek vaak niet beschikbaar en kan er op deze wijze geen nader onderzoek plaatsvinden. Hieraan voorafgaand vindt er bij het referentielaboratorium een intern onderzoek plaats, waarbij alle processtappen worden nagelopen om mogelijke fouten op dit niveau uit te sluiten.
In het medisch-microbiologisch laboratorium (MML) waar de vermoedelijk fout-positieve kweek vandaan is gekomen, worden idealiter de interne processen en de werkzaamheden op de dag waarop de kweken werden ingezet, nauwkeurig in kaart gebracht, met het oog op procedures die mogelijk niet goed gefunctioneerd hebben of niet op de juiste wijze werden gevolgd. Tevens wordt gecontroleerd of er sprake is geweest van een groter dan normaal aantal positieve kweken op de dag dat de vermoedelijke LKC werd ingezet. Ook de wijze van bewerking van het klinische materiaal kan een aanwijzing zijn voor een groter risico op een LKC; gesprekken met de betrokken analisten leveren hierbij vaak belangrijke inzichten op. Daarna volgt er overleg tussen de arts-microbioloog en de behandelaar, waarbij wordt nagegaan of de klinische diagnose ‘tuberculose’ ruimte over laat voor twijfel aan het positieve kweekresultaat. Op basis van de interne bevindingen bij het MML en de informatie van de behandelaar besluit de arts-microbioloog in samenspraak met de behandelaar of het vermoeden van een LKC wordt bevestigd of niet. Indien er na de melding vanuit het RIVM geen reactie komt van het betreffende MML binnen 14 dagen, wordt er contact opgenomen met de betreffende arts-microbioloog om naar de stand van zaken te informeren.
Indien er sprake is van een LKC en de diagnose wordt ingetrokken, dient de GGD hiervan zo spoedig mogelijk op de hoogte te worden gesteld door de behandelaar. Het RIVM wordt tevens geïnformeerd over het weerleggen of bevestigen van de LKC door de arts-microbioloog van het MML. Omdat de gevolgen voor de betreffende patiënt groot kunnen zijn, is het de bedoeling om deze procedure van verificatie zo snel mogelijk te doorlopen, in ieder geval binnen 14 dagen.
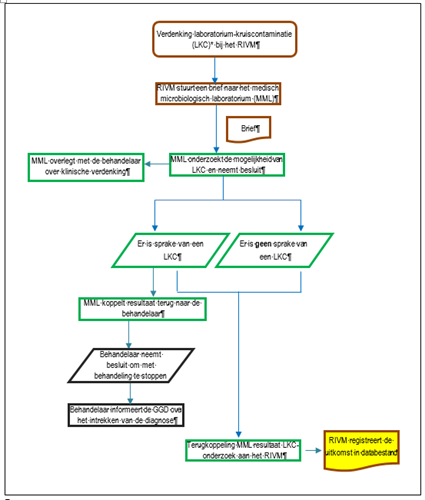
Figuur 1 geeft de werkwijze van het tuberculosereferentielaboratorium van het RIVM schematisch weer.
Figuur 1. Stroomdiagram LKC
Trend in de detectie van laboratoriumkruiscontaminaties
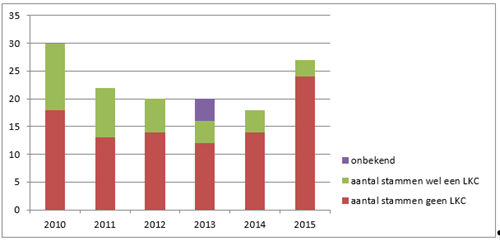
Bij een incident van een vermoedelijke LKC kunnen meer dan twee patiënten betrokken zijn, maar ook meerdere stammen per patiënt. Er is een retrospectieve studie gedaan naar het voorkomen van LKC’s in de afgelopen jaren. In een periode van zes jaar (2010-2015) waren er 66 meldingen van een vermoedelijke LKC, waarbij 137 positieve kweken waren betrokken. Van de 137 van LKC verdachte kweken bleef bij 95 patiënten (69 procent) de diagnose ‘tuberculose’ gehandhaafd, terwijl bij 38 personen (28 procent) werd bevestigd dat het een laboratorium-kruiscontaminatie betrof. Bij vier kweken is dit onbekend gebleven. Omdat er 38 tuberculosesdiagnoses werden herroepen van de in totaal 3880 kweek-positieve patiënten met tuberculose in de periode 2010-2015, is te stellen dat 1,0 procent van alle kweekbevestigde diagnoses berust op een bevestigde LKC.
In totaal waren hierbij 25 laboratoria betrokken. Er was in deze periode geen duidelijk verband tussen het aantal kweken dat door een laboratorium werd opgestuurd naar het RIVM en het voorkomen van LKC’s.
Problemen bij het signaleren van vermoedelijke laboratorium-kruiscontaminaties
De genetisch geconserveerde M. tuberculosis complex-stammen die worden gekweekt bij een deel van de asielzoekers zorgen voor meer niet-bevestigde meldingen van LKC’s. Met de toename van het aantal tuberculosepatiënten onder asielzoekers in de laatste jaren is ook de kans op een vermoedelijke LKC groter geworden in de laboratoria die veel van dit soort stammen kweken. In 2015 zond het Certe laboratorium in Groningen 98 stammen naar het RIVM, waarbij er enkele keren een LKC werd vermoed. Omdat in de meeste gevallen het klinische beeld geen twijfel bood aan de diagnose ‘tuberculose’, bleef deze gehandhaafd.
Er zijn recent aanwijzingen gevonden dat de stammen die worden geïsoleerd bij asielzoekers vanuit de Hoorn van Afrika regelmatig clusteren op grond van VNTR-typering, terwijl ze met Whole Genome Sequencing (WGS) niet identiek zijn, maar wel een zeer beperkte genetische afstand vertonen van slechts enkele tientallen mutaties (publicatie in voorbereiding). WGS kan er dus in de toekomst aan bijdragen om LKC’s nauwkeuriger op te sporen en het aantal vermoedelijke contaminaties te verkleinen.
Niet-reguliere LKC-casuïstiek uit de praktijk waarbij de rol van DNA-fingerprinting essentieel was
Casus 1
Van een hiv-positieve patiënt (A), opgenomen op een afdeling Interne Geneeskunde met waterpokken en een orale candidiasis, werd een sputum ingestuurd, dat positief was in de auramine (1+) en M. tuberculosis complex-specifieke PCR. Aanvankelijk werd op basis van een lage verdenking voor tuberculose alleen opnieuw gestart met HAART, maar vanwege de uitslag van een CT-thorax werd toch gestart met tuberculostatica. Zijn hiv-medicatie werd hiervoor aangepast. De kweek werd ook positief en volgens protocol ingestuurd naar het referentie-laboratorium voor DNA-fingerprintanalyse. Nieuw afgenomen sputum bleef negatief.
Met een kleine overlap in opnameduur werd op diezelfde afdeling enkele dagen eerder patiënt B opgenomen in verband met een verdenking op pulmonale tuberculose en een de novo hiv-2-infectie. Twee van de drie sputa waren auraminepositief, bevestigd door een positieve PCR. Er werd gestart met tuberculostatica en HAART, en de kweken toonden een goed gevoelige M. tuberculosis. Het referentie-laboratorium meldde dat de DNA-fingerprint van het M. tuberculosis-isolaat van patiënt A identiek was aan dat van patiënt B, op grond waarvan er verder onderzoek is ingesteld. Analyse van de materiaalstromen van beide patiënten liet zien dat zowel tijdens het inzetten van de kweken als tijdens de analyse van de positieve kweken, de materialen elkaar niet gekruist hebben. Daarom rees er twijfel over de herkomst van het auraminepositieve sputum van patiënt A en is dit materiaal, tezamen met een later sputummonster van patiënt A en een sputummonster van patiënt B (van vóór ziekenhuisopname van patiënt A), geanalyseerd met een Short Tandem Repeat PCR (ook in gebruik als vaderschapstest). Daaruit bleek dat het humane DNA in het sputum met twijfelachtige herkomst - niet van patiënt A afkomstig was, maar van patiënt B. Hiermee werd zeer aannemelijk gemaakt dat de sputumcontainer op de afdeling met een verkeerde patiëntensticker gelabeld is en werd de tuberculosebehandeling van patiënt A gestaakt.
Casus 2
Er worden soms ook LKC’s gevonden buiten het algoritme om dat in deze publicatie is beschreven.
Zo merkte het referentielaboratorium recent op dat er twee kweken waren met een resistentie tegen isoniazide en rifampicine (multidrugresistentie) en een zeer uitzonderlijke mutatie in het pncA-gen die geassocieerd is met pyrazinamide-resistentie. Enkele dagen later bleek dat de VNTR-patronen van deze stammen ook identiek waren. De twee kweken waren afkomstig van verschillende laboratoria en kwamen dus niet in aanmerking voor melding van een vermoedelijke LKC, maar vanwege het bovenstaande werd het betrokken regionale laboratorium toch telefonisch op de hoogte gesteld van de vermoedelijke LKC. Uit de verificatie bleek dat een recent ingewerkte analist bij het inzetten van een serie kweken de materialen na inzetten niet structureel had verplaatst in het rekje waar de kweekbuizen op stonden, waardoor een positief sputum van een patiënt met MDR-tuberculose ook werd geïnoculeerd op de set media van een andere patiënt. Deze patiënt met MDR-tuberculose werd behandeld in een van de twee tuberculosecentra, maar de diagnose was elders in het land gesteld en de MML uit die regio was de inzender van het materiaal naar het RIVM. De tweede ‘patiënt’ woonde in het gebied waar ook het tuberculosecentrum is gesitueerd en waar de fout in het laboratorium werd gemaakt. Op basis van de snelle verdenking en bevestiging van de LKC kon behandeling voor MDR-tuberculose na enkele weken worden gestaakt en de diagnose ‘MDR-TB’ worden ingetrokken.
Casus 3
Een derde casus betreft een patiënt bij wie een negatieve tuberculinehuidtest en een afwijkende longfoto werden gevonden in een contactonderzoek. De longarts verrichtte vervolgens een bronchoscopie ter uitsluiting van (andere) pathologie. Onverwachts kwam er een positieve M. tuberculosis uit de kweek van het bronchoalveolaire lavagevloeistof, waarna behandeling voor tuberculose werd gestart. Na een aantal weken meldde het RIVM dat het een M. bovis-BCG-stam betrof. De speurtocht naar de mogelijke contaminatie met de BCG-stammen die worden gebruikt voor blaaskankertherapie (BCG-blaasinstillaties) en voor BCG-vaccinatie, leverde aanvankelijk niets op en de behandeling werd gecontinueerd. Beide BCG-stammen werden overigens niet in het betreffende ziekenhuis gebruikt. Na vier maanden werd met DNA-fingerprinting duidelijk gemaakt dat er een LKC was ontstaan met een M. bovis-BCG-stam (Danish strain 1331) die werd gebruikt in een kwaliteitscontrolerondzending waaraan het betreffende MML had deelgenomen. Het VNTR-profiel van het isolaat en die van de vaccinstam kwamen namelijk overeen. De behandeling werd daarop gestaakt en de diagnose ingetrokken.
Discussie
LKC’s vormen een blijvend risico in de diagnostiek van tuberculose, met potentieel grote gevolgen voor patiënten, zoals isolatiemaatregelen, onnodige behandeling met bijwerkingen, onzekerheid en stress door deze ingrijpende diagnose en onnodig onderzoek van contacten.8 Ook levert het waarnemen van een vermoedelijke LKC veel onrust in de betrokken laboratoria en bij de tuberculosebehandelaars.
DNA-fingerprinting van M. tuberculosis-isolaten blijkt een uitstekend instrument om deze fouten in de diagnostiek op te sporen, de gevolgen voor de patiënten te beperken en om te leren van de waarnemingen, zodat dit soort problemen in de toekomst zoveel mogelijk kunnen worden voorkomen.9 Toch zijn er nog verbeterpunten denkbaar in de procedure. In de huidige praktijk, waarbij de diverse stappen in de diagnostiek van patiënten vaak plaatsvinden bij verschillende laboratoria, is het in kaart brengen van een LKC extra lastig geworden. Het referentielaboratorium heeft in principe uitsluitend contact met het MML dat een kweek instuurt naar het RIVM, maar dit inzendende laboratorium is mogelijk de laatste schakel in de keten van betrokken instanties. Het is hierbij niet altijd even duidelijk welke partij verantwoordelijkheid is voor het onderzoek naar de vermoedelijke LKC. Op grond van het aantal bevestigde LKC’s en de mogelijke gevolgen voor de betrokken patiënten heeft het referentielaboratorium de procedure daarom verduidelijkt en beschreven in het stroomdiagram (figuur 1).
Wanneer de inzender wordt geïnformeerd over een vermoedelijke LKC, houdt dat in feite ook in dat aan het inzendende MML wordt gevraagd om de gevoerde procedures aan een kritische evaluatie te onderwerpen; dit vereist zelfreflectie. De terugkoppeling naar het referentielaboratorium verloopt over het algemeen goed, maar er is nog ruimte voor verdere verbetering. Vooral het gebrek aan snelheid in het reageren op meldingen is een punt van zorg, omdat soms de onnodige behandeling langer duurt dan strikt genomen noodzakelijk is.
Vanwege de gevolgen van foutpositieve diagnostiek voor de patiënt blijft de detectie van LKC’s en het systematisch onderzoeken van de onderliggende oorzaken belangrijk. Dit kan leiden tot verdere verbetering van laboratorium-protocollen. Natuurlijk blijven LKC’s een pijnlijke realiteit die schade kunnen berokkenen aan het vertrouwen van patiënten in de zorg en van clinici in de laboratoria.
Ondanks alle geautomatiseerde processen blijft het menselijk handelen een belangrijk onderdeel van de laboratoriumwerkzaamheden. In Nederland hebben we DNA-fingerprintingmethoden beschik-baar om vermoedelijke LKC’s op te sporen en te onderzoeken. Dit voorkomt onterechte behandeling en bespaart menselijk lijden en ook geld. Alleen met een grote mate van transparantie en eerlijkheid kan er maximale lering worden getrokken uit elkaars ervaringen.
Vanaf 2016 draait er bij het RIVM een vierjarig promotie-/researchproject om de rol van Whole Genome Sequencing (WGS) van M. tuberculosis-isolaten in de tuberculosediagnostiek nader te evalueren.7 Vanwege de hogere resolutie in typering is de verwachting dat op grond van deze nieuwe techniek minder vaak een (onterecht) signaal zal worden afgegeven van mogelijk foutpositieve kweken, vooral van asielzoekers. Op dit moment kan WGS uitsluitend op betrouwbare wijze worden toegepast op positieve M. tuberculosis-kweken. Het is niet ondenkbaar dat binnen enkele jaren WGS ook direct kan worden toegepast op klinisch materiaal waarin zich een voldoende aantal mycobacteriën bevindt. Wanneer het zover is, kan een groot deel van de diagnostiek met WGS worden uitgevoerd en kan het kweken veelal achterwege blijven, waardoor het risico op LKC sterk zal afnemen.