Samenvatting
De relatie tussen dragerschap en ziekte kan worden gebruikt voor het monitoren van de effectiviteit van vaccinatieprogramma’s gericht tegen respiratoire bacteriën. De gouden standaard voor dragerschapsdetectie is bacteriekweek uit een nasofaryngeale (pneumokokken) en orofaryngeale (meningokokken) swab. Detectie van deze bacteriën kan worden uitgebreid door het testen van speeksel. De hoge microbiële dichtheid en diversiteit van orale monsters compliceren echter de kweek, waardoor de gevoeligheid van deze methode wordt verminderd. Door gebruik te maken van moleculaire methoden kan de detectie van deze potentiele pathogenen sterk worden verbeterd. Met nieuwe moleculaire diagnostiek hebben we aangetoond dat orofaryngeale swabs superieur zijn in vergelijking met nasofaryngeale swabs voor het aantonen van pneumokokkendragerschap bij volwassenen. Met moleculaire diagnostiek is tevens aangetoond dat speeksel een belangrijk reservoir is voor pneumokokken bij volwassenen, een bevinding die in het begin van de vorige eeuw ook werd waargenomen. Het gebruik van speeksel voor surveillance van pneumokokkenziekte en andere respiratoire bacteriële infecties moet nog verder worden onderzocht.
Aandoeningen aan de luchtwegen, waaronder longontsteking (pneumonie), vormen samen met cardiovasculaire ziekten en kanker de belangrijkste oorzaak van sterfte in Europa. Streptococcus pneumoniae (pneumokok) is de meest voorkomende bacteriële ziekteverwekker van buiten een zorginstelling opgelopen pneumonie (community-acquired pneumonia; CAP). Daarnaast is de pneumokok, ondanks de beschikbaarheid van vaccins, de oorzaak van 75 procent van alle invasieve bacteriële infecties. Wereldwijd overlijden jaarlijks één miljoen volwassenen en 500.000 kinderen (5 procent van de totale kindersterfte) als gevolg van infectie met S. pneumoniae.[1] De hoogste incidentie van invasieve pneumokokkenziekte (IPD) wordt gevonden bij volwassenen boven de 65 jaar, meestal als gevolg van een invasieve pneumonie, vooral bij volwassenen van 75 jaar en ouder.
Ondanks de hoge ziektelast veroorzaakt door pneumokokkenziekte, maken pneumokokken deel uit van de commensale microbiota van de bovenste luchtwegen en vindt transmissie van mens op mens vaak plaatst zonder klinische verschijnselen. Deze vorm van kolonisatie, ook wel dragerschap genoemd, komt het meest voor bij kinderen. Kinderen onder de drie jaar hebben een dragerschapprevalentie van 60 tot 80 procent en zijn hiermee het belangrijkste reservoir van pneumokokken in de populatie.[2] Ondanks de hoge ziektelast bij ouderen werd er tot voor kort nauwelijks dragerschap van de bacterie gerapporteerd in deze groep.
Abstract
The link between carriage and disease is utilized in monitoring effects of vaccines targeting respiratory bacteria. The gold standard for carriage detection is the culturing of live bacteria from nasopharyngeal (pneumococcus) or oropharyngeal (meningococci) swabs. These samples can be complemented with collection of saliva. A critical factor for oral samples is the high density and diversity of bacteria which diminishes the sensitivity of culture. Molecular methods have largely improved the detection of pathogens. By applying molecular diagnostics we have reported oropharyngeal swabs in adults to be superior to nasopharyngeal swabs for the detection of pneumococci. More importantly, we detected a large reservoir of pneumococci in the saliva of carriers, a finding in line with century-old studies reporting on high carriage rates. The use of saliva in the surveillance of pneumococcal disease and of other respiratory diseases needs to be explored.
Pneumokokkenvaccins
Het belangrijkste antigeen van de pneumokok, een grampositieve diplokok, is het kapsel van polysacharide. Afhankelijk van de samenstelling van verschillende kapselpolysachariden kunnen meer dan 90 serotypen worden onderscheiden. Antistoffen tegen dit kapselantigeen beschermen tegen ziekte. Van alle serotypen is 25 procent verantwoordelijk voor meer dan 80 procent van alle invasieve pneumokokkenziekten. Er zijn momenteel twee typen vaccin beschikbaar, beide op basis van het kapselpolysachariden als antigeen. Het 23-valente polysacharidevaccin bevat kapselantigenen van 23 serotypen. Dit polysacharidevaccin wordt aanbevolen voor ouderen boven de 60 jaar.[3] Het polysacharidevaccin induceert echter een onvoldoende hoge en blijvende immuunrespons bij zuigelingen. Het tweede type vaccin, de polysacharide-eiwitconjugaatvaccins (PCV), induceren wel voldoende beschermende antistoffen en immunologisch geheugen na twee of meer vaccinaties bij hele jonge zuigelingen. Vaccinatie van zuigelingen met PCV’s biedt niet alleen bescherming tegen systemische en lokale infecties veroorzaakt door serotypen die zijn opgenomen in het conjugaatvaccin maar hiermee wordt ook acquisitie van dragerschap met vaccintypen (VT) voorkomen. Sinds de introductie van PCV-7 in 2006 in het Rijksvaccinatieprogramma en de vervanging door PCV-10 in 2011 voor zuigelingen, is in Nederland sprake van een afname van meer dan 90 procent van zowel VT-dragerschap als ziekte.[4] Deze afname wordt niet alleen bij gevaccineerde zuigelingen waargenomen, maar in alle leeftijdsgroepen door preventie van dragerschap en verspreiding van VT’s door kinderen (groepsimmuniteit). De huidige 10-valente en 13-valente PCV’s bieden echter uitsluitende bescherming tegen 10 tot 13 van de meer dan 90 bekende serotypen. Na de introductie van de PCV’s hebben bovendien niet-vaccin serotypen voor een belangrijk deel de ecologische niche ingevuld in dragerschap bij kinderen. Deze niet-vaccin serotypen veroorzaken in toenemende mate ziekte in de populatie, niet zozeer bij kinderen, maar vooral bij ouderen die meer dan 90 procent van alle ziektelast vertegenwoordigen. De zorg is dat deze ‘serotype replacement’ het effect van PCV’s in de bescherming tegen pneumokokkenziekte progressief ondermijnt.
Verbetering van pneumokokkensurveillance
Voor een effectief vaccinatiebeleid is anticipatie op veranderingen in serotypen en stammen die verantwoordelijk zijn voor de ziektelast, van cruciaal belang. Beter inzicht in de onderliggende mechanismen van de indirecte gevolgen van vaccinatie, zoals groepsimmuniteit en ‘serotype replacement’, vereisen monitoring van pneumokokken, niet alleen bij patiënten maar ook bij het reservoir van asymptomatische dragers. In Nederland wordt de impact van pneumokokkenvaccinatie geëvalueerd door de monitoring en serotypering van isolaten van 25 procent van alle IPD-patiënten door het Referentie Laboratorium voor Bacteriële Meningitis van het AMC. Daarnaast wordt sinds 2005 pneumokokkendragerschap bij jonge kinderen en hun ouders iedere drie jaar gemonitord met behulp van crosssectionele cohortonderzoeken. Hoewel met deze surveillance van IPD en dragerschap de impact van PCV-vaccinatie goed te volgen is, blijft de huidige surveillance niet toereikend voor een volledig beeld van de dynamiek van pneumokokken onder invloed van vaccinatie en tijd. Het evalueren van bestaande en het opzetten van toekomstige interventiestrategieën voor pneumokokkenziekte vereist accurate data. Dit geldt zowel voor pneumokokkenziekten, waaronder CAP, als voor asymptomatisch dragerschap. Dit moet worden uitgevoerd in alle leeftijdsgroepen, met name ouderen, en in groepen met en zonder verhoogd risico. De gouden standaard van de World Health Organisation (WHO) - het kweken van nasofarynx- (en monsters van orofarynxswab bij volwassenen) - is hiervoor te weinig sensitief, vanwege de lage densiteit van pneumokokkendragerschap bij volwassenen en ouderen.[5] Moleculaire diagnostiek en het gebruik van speeksel als surveillancemiddel geven nieuwe mogelijkheden voor dragerschapsdetectie. Op deze wijze wordt ook bij volwassenen 20 tot 40 procent dragerschap van pneumokokken vastgesteld.[5,6] Om deze reden zet het RIVM in op nieuwe diagnostische methoden met moleculaire technieken, om dragerschap en verspreiding bij volwassenen en vooral ouderen beter te monitoren. Ook is standaardisatie van afname en verwerking van monsters van groot belang voor betrouwbare vergelijking tussen studies en landen.
Maximalisatie van S. pneumoniae-detectie
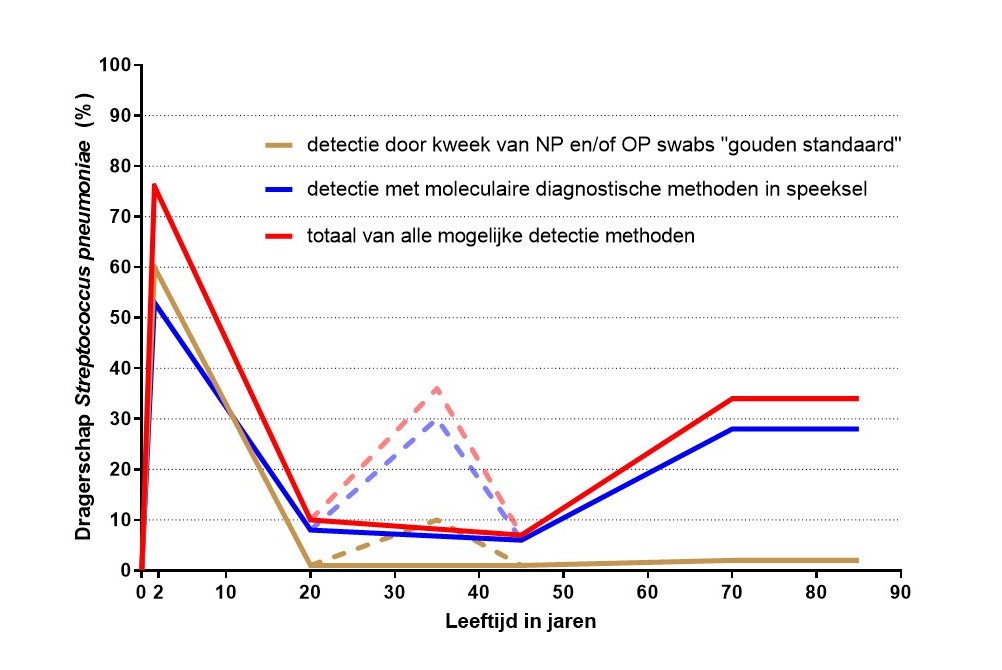
Een van de belangrijkste uitdagingen is het verbeteren van de sensitiviteit en specificiteit van de huidige detectiemethoden voor pneumokokken. Hoewel het kweken en serotyperen van nasofaryngeale uitstrijkjes nog steeds een uitstekende methode is voor het monitoren van dragerschap van pneumokokken bij zuigelingen en jonge kinderen, tonen onze recente studies aan dat de gevoeligheid van deze aanpak snel afneemt met de leeftijd. Dit is vooral het geval bij kinderen van vijf jaar en ouder, omdat de densiteit van dragerschap dan afneemt en de orofarynx een belangrijke niche voor pneumokokkendragerschap wordt.[2] Wij hebben laten zien dat bij volwassenen detectie in speeksel met behulp van moleculaire methoden gevoeliger is dan de ‘gouden standaard’ van de WHO, waarbij wordt gekweekt uit nasofarynx en orofarynx (figuur 1).[5-9] Moleculaire methoden vereenvoudigen daarnaast de determinatie van serotypen en kwantificeren de dynamiek van dragerschap over de tijd. Dit maakt speeksel, dat eenvoudig en niet-invasief kan worden verzameld, zeer geschikt voor dragerschapsurveillance in alle leeftijdsgroepen. Speeksel kan ook worden gebruikt voor immunologische monitoring van IgG- en IgA-antilichamen geïnduceerd na PCV- vaccinatie of na blootstelling door dragerschap. Hoewel er aanwijzingen zijn voor onderdiagnose van S. pneumoniae-geïnduceerde pneumonie vanwege een beperkte detectie van pneumokokken bij volwassenen met de huidige diagnostische testen, moet de eventuele geschiktheid van speeksel voor de surveillance van pneumokokkenziekte en andere respiratoire infecties nog verder worden onderzocht. Studies hiernaar zijn inmiddels opgestart, waarbij samenwerkingen met ziekenhuizen en medisch-microbiologische laboratoria essentieel zijn. Tevens is synchronisatie en integratie van verschillende studies bij patiënten bij wie andere ziekteverwekkers worden bestudeerd, van belang.
Toekomst van surveillance
Optimalisatie van interventiestrategieën om luchtweginfecties te reduceren vereisen een integrale aanpak. Daarbij moet de surveillance van S. pneumoniae en andere respiratoire bacteriële pathogenen worden geïntegreerd in kosteneffectiviteitsstudies en impactstudies naar het effect van preventieve en therapeutische interventies. Hierbij dienen andere factoren die bijdragen aan het infectierisico ook meegenomen te worden, zoals leeftijd, comorbiditeit, virale luchtweginfecties, genetica van de gastheer, luchtkwaliteit en sociaaleconomische factoren.
Surveillanceprogramma’s in bestaande cohorten zouden moeten worden uitgebreid met longitudinale dragerschapsstudies, transmissiestudies en studies naar verbeterde diagnostiek bij pneumokokkenpneumonie. Een andere prioriteit is de implementatie van gestandaardiseerde data-analyse voor ‘deep sequencing’ van polymicrobiële monsters en ‘whole genome sequencing‘ (WGS) van individuele bacteriële stammen.
We zijn van mening dat effectieve surveillance in de toekomst berust op het samenbrengen van diverse benaderingen waaronder de huidige conventionele diagnostiek, kweekonafhankelijke moleculaire diagnostiek, WGS voor het in kaart brengen van de populatiestructuur en immunosurveillance van de vaccinrespons. De meest kosteneffectieve aanpak zal afhangen van de specifieke vraagstelling, waarbij rekening dient te worden gehouden met de limitatie van de diverse methoden. Het RIVM heeft meer dan een decennium ervaring in de surveillance van pneumokokkendragerschap onder kinderen en de surveillance van IPD. Onze ambitie is het verder ontwikkelen, valideren en implementeren van innovatieve surveillancemethoden, omdat dit volgens ons de sleutel vormt voor weloverwogen beslissingen over toekomstige vaccinatieprogramma’s.