Samenvatting
Een persistente infectie met humaan papillomavirus (HPV) kan op termijn leiden tot verschillende soorten (pre-)maligne laesies in de anogenitale en orofaryngeale streek. Sinds 2006 zijn er drie verschillende profylactische vaccins geregistreerd die bescherming bieden tegen hoogrisicotypen HPV. Deze vaccins hebben de potentie om de door HPV veroorzaakte ziektelast sterk te verminderen. In Nederland is sinds 2010 het bivalente HPV-vaccin opgenomen in het Rijksvaccinatieprogramma voor 12-jarige meisjes. De vaccins zijn veilig en zeer effectief in de bescherming tegen (persisterende) hoogrisico-HPV-infecties, zoals ook blijkt uit verschillende Nederlandse onderzoeken. Wanneer in 2023 de eerste gevaccineerde cohorten het bevolkingsonderzoek baarmoederhalskanker instromen, worden naar verwachting ook de eerste effecten op ziekteniveau ((pre)kanker laesies) zichtbaar. In juni 2019 bracht de Gezondheidsraad een advies uit om, naast meisjes, ook jongens te vaccineren tegen HPV en om het vaccin voortaan aan te bieden rond de leeftijd van negen jaar. Tevens adviseert de Gezondheidsraad om volwassenen tot en met 26 jaar de kans te geven zich alsnog te laten vaccineren. In september 2019 besloot het ministerie van Volksgezondheid, Welzijn en Sport het advies van de Gezondheidsraad over te nemen met ingang van 2021.
Abstract
A persisting infection with Human Papillomavirus (HPV) can eventually lead to premalignant lesions on the anogenital and oropharyngeal sites. From 2006 onwards, three prophylactic vaccines have been registered for the protection against high-risk types HPV. These vaccines have the ability to strongly reduce the disease burden caused by HPV. In the Netherlands, the bivalent HPV-vaccine was introduced into the National Immunization Program in 2010 as a girls-only vaccine for 12-year-olds. The HPV-vaccines have been shown to be safe and highly effective against (persistent) high-risk HPV infections, as is also evidenced by multiple Dutch studies. When the first vaccinated birth cohorts enter the cervical cancer screening program in 2023, the first effects on disease outcomes are expected to be visible. In June 2019, the Dutch Health council advised to start vaccinating boys in addition to girls and to change the age of vaccination to 9 years. Moreover, the Health Council advices to offer adults up to 26 years of age the opportunity to get the HPV-vaccine through a supplemental vaccination program. In September 2019, the Ministry decided to follow the advice from the Health Council starting from 2021.
Inleiding
HPV-infectie is de veroorzaker van baarmoederhalskanker en van andere HPV-gerelateerde kankers aan de penis, anus, vulva en orofarynx. Sinds 2006 zijn vaccins beschikbaar die bescherming geven tegen verschillende hoogrisicotypen HPV. Sinds 2010 is het bivalente HPV16/18-vaccin opgenomen in het Rijksvaccinatieprogramma (RVP) voor 12-jarige meisjes. In dit artikel wordt achtereenvolgens ingegaan op het humaan papillomavirus, de pathogenese van het virus, de vaccins, opname van het bivalente vaccin en monitoring hiervan in het RVP en onderzoek.
HPV
Een infectie met het humaan papillomavirus (HPV) is, met een geschat percentage van 80 procent van de mensen die ooit een infectie doormaken, de meest voorkomende seksueel overdraagbare infectie.[1] HPV is een klein, dubbelstrengs DNA-virus uit de Papillomaviridae-familie en kent veel verschillende typen, waarvan er tot nu toe meer dan 200 zijn gekarakteriseerd.[2] De typen worden gegroepeerd binnen verschillende genera, waarvan het alfagenus bestaat uit ongeveer 40 typen die de genitale slijmvliezen kunnen infecteren.[3] Er wordt onderscheid gemaakt tussen hoog- en laagrisicotypen HPV op basis van oncogeen potentieel; van 14 typen (HPV16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 66 en 68) is bekend dat zij kanker kunnen veroorzaken, waarvan baarmoederhalskanker de meest voorkomende anogenitale kanker is.[3,4] Daarnaast betreft het ook een deel van de penis-, anus-, vagina- en vulvakankers en van de kankers in het hoofd-halsgebied. Naast hoogrisicotypen zijn er ook laagrisicotypen HPV binnen het alfa-genus die geassocieerd zijn met het ontwikkelen van genitale wratten en laaggradige laesies. HPV6/11 zijn de typen die hierin de grootste bijdrage hebben, met een geschatte attributie van 90 procent aan alle genitale wratten.[5]
Pathogenese
De pathogenese voor het verloop van HPV-infectie tot aan maligniteit is het beste beschreven voor baarmoederhalskanker. Een aanhoudende, transformerende infectie met een hoogrisicotype HPV (hrHPV) is een noodzakelijke voorwaarde voor het ontwikkelen van baarmoederhalskanker. HPV kan de basale lagen van het plaveiselepitheel van de cervix infecteren, waarvoor microlaesies (die veelal ontstaan gedurende geslachtsgemeenschap) in het epitheel nodig zijn. Een productieve infectie ontstaat wanneer virusdeeltjes worden uitgescheiden naar het epitheel oppervlak.[6] Ongeveer 80 tot 90 procent van de productieve infecties wordt geklaard door het immuunsysteem, waarbij het virus niet meer gedetecteerd wordt in achtereenvolgende metingen, en verloopt symptoomloos.[7] Virale latentie en mogelijk ook reactivatie bij veranderende omstandigheden kan hierbij niet worden uitgesloten.[5]
In sommige gevallen kan een HPV-infectie aanhouden (persisteren) en veranderen in een transformerende infectie, waarbij voorloperstadia van baarmoederhalskanker kunnen ontstaan, die CIN-laesies (cervicale intra-epitheliale neoplasie) worden genoemd. De early genes van het virus spelen hierbij een belangrijke rol, waarbij E2 vooral betrokken is in de fase van replicatie en de regulatie van E6 en E7, die gezien worden als de virale oncogenen die de celproliferatie stimuleren en herstel voorkomen. De deregulering van deze genen kan zorgen voor een opeenstapeling van genetische fouten, die kunnen leiden tot virale integratie in het genoom van de gastheer, iets wat vaak wordt gezien in baarmoederhalskanker.[5,7]
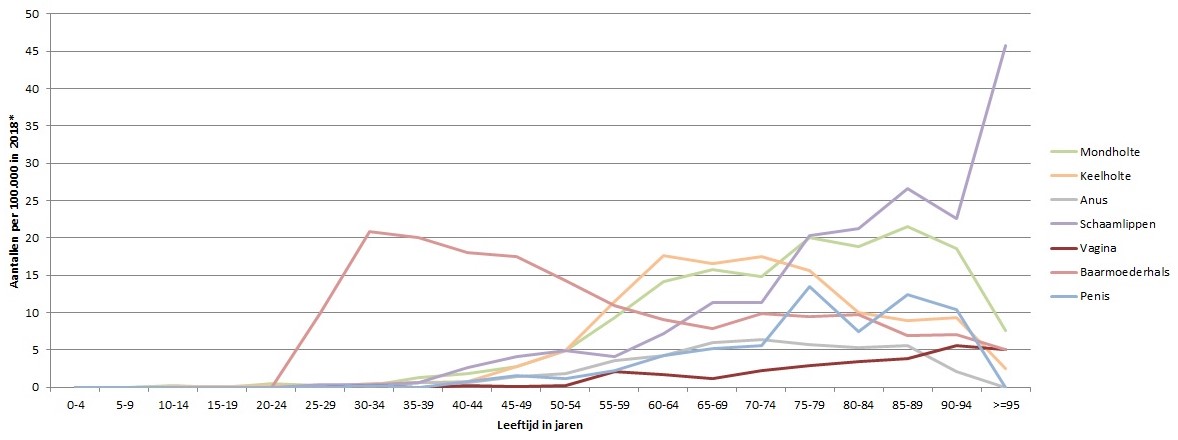
Er worden laaggradige (CIN1 en deel CIN2) en hooggradige (deel CIN2 en CIN3) afwijkingen onderscheiden, waarbij de hooggradige laesies worden beschouwd als voorloperstadia van cervixcarcinoom.[8] Regressie kan te allen tijde optreden door klaring van het virus, maar hoe hoger de graad van de laesie, hoe kleiner deze kans. De tijd die nodig is om een hooggradige laesie te ontwikkelen wordt geschat op enkele jaren, terwijl voor het ontwikkelen van maligniteit vanuit de primaire infectie meer tijd nodig is; zo’n 12 tot 15 jaar.[9] Ongeveer 70 procent van alle baarmoederhalskanker worden veroorzaakt door HPV16/18.[10] In Nederland worden jaarlijks tussen de 700 en 800 vrouwen gediagnosticeerd met baarmoederhalskanker en overlijden ongeveer 200 vrouwen aan deze vorm van kanker. Tevens kunnen andere anogenitale kankers, waaronder peniskanker (circa 160 nieuwe gevallen per jaar), anuskanker (circa 200 tot 300), vaginakanker (circa 60) en vulvakanker (circa 300 tot 400) en mond- en keelholtekankers (circa 1600 tot 1800) worden veroorzaakt door een aanhoudende hrHPV-infectie (figuur 1), waarbij HPV16 ook bij deze vormen van kanker het meest voorkomt. In tegenstelling tot baarmoederhalskanker is bij de andere genoemde kankervormen een HPV-infectie niet altijd de aanleiding en spelen andere factoren een rol in de pathogenese.[11,12]
Epidemiologie
HPV komt veel voor en besmetting vindt plaats door direct epitheelcontact, waarbij seks de belangrijkste manier van overdracht is. HPV is zeer besmettelijk en mede daardoor is penetratie geen noodzakelijke voorwaarde voor infectie; contact van de genitale zones kan voldoende zijn. Een toename in de prevalentie van HPV wordt gezien vanaf het begin van de seksuele activiteit. Voor vrouwen met normale cytologie ligt de piekprevalentie tussen de 20 en 25 jaar, waarna deze met toenemende leeftijd afneemt.[3] Voor mannen lijkt de prevalentie stabieler gedurende het leven, hoewel daarover minder bekend is. Tevens zijn de internationale verschillen in prevalentie groot, met hogere schattingen voor Afrika, Oost-Europa en Zuid-Amerika vergeleken met Westerse landen en Azië.[13] Risicofactoren voor het oplopen van een infectie zijn vooral gerelateerd aan seksueel gedrag, zoals het aantal sekspartners gedurende het leven.[14]
HPV-vaccinatie
Sinds 2006 zijn er verschillende profylactische vaccins voor primaire preventie tegen HPV geregistreerd, die gebaseerd zijn op het L1-eiwit (manteleiwit) van het virus. Op basis van virus-like particles (VLP’s) in het vaccin (aangevuld met adjuvans), wordt een immunologische respons en geheugen geïnduceerd zonder dat er sprake is van infectie.[15] Door te vaccineren vóór seksueel debuut wordt een optimale bescherming bewerkstelligd. De vaccins verschillen in aantal HPV-typen waartegen zij bescherming bieden; het bivalente vaccin (Cervarix, GSK) is gericht tegen HPV16/18. In het quadrivalente vaccin (Gardasil, MSD) zijn daar ook de twee meest voorkomende laagrisicotypen HPV6 en 11 aan toegevoegd. Beide vaccins bieden daarnaast kruisbescherming tegen enkele andere hrHPV-typen. Enkele jaren later is een nonavalent vaccin op de markt gebracht (Gardasil9, MSD, 2015), dat niet alleen bescherming biedt tegen HPV6/11/16/18 maar ook tegen hoogrisicotypen HPV31/33/45/52/58.
HPV-vaccinatie werd oorspronkelijk geregistreerd voor bescherming tegen baarmoederhalskanker, maar inmiddels is dit uitgebreid naar anus-, vagina- en vulvalaesies. De vaccins kunnen gebruikt worden voor kinderen van negen jaar en ouder. Initieel werd een driedosesschema geadviseerd, maar na een advies van de European Medicines Agency (EMA) in 2014 werd dit aangepast naar een tweedosesschema. Uit immunobridgingsstudies bleek dat de immunogeniciteit onder jonge meisjes (9 tot 14 jaar) die met twee doses waren gevaccineerd, niet inferieur was aan de immunogeniciteit in een oudere populatie (15 tot 25 jaar) die gevaccineerd was met drie doses en bij wie een zeer hoge effectiviteit waargenomen werd.[16,17] Het principe van immunobridging gaat ervan uit dat bij een niet-inferieure immunologische respons, de effectiviteit ook niet inferieur zal zijn. Bij de start van het vaccinatieschema op 15-jarige leeftijd of later wordt geadviseerd alsnog een driedosesschema aan te houden (0, 1, 6 maanden).
Over het therapeutische effect van de huidige vaccins bij een bestaande infectie is tot op heden weinig bekend; de vaccins werken het beste wanneer ze gegeven worden vóór blootstelling aan het virus en zijn ook met dit doel ontwikkeld. Binnen de RCT’s zijn wel deelnemersgroepen geïncludeerd die niet HPV-negatief waren bij aanvang (de zogeheten ‘intention to treat populations’). De vaccineffectiviteit in deze groepen ligt over het algemeen lager.[18,19] Daarnaast wordt in Nederland momenteel de VacCIN-studie uitgevoerd (Aduvant VACcination against HPV in surgical treatment of CIN-lesions, a Randomized Controlled Trial), waarin wordt onderzocht of HPV-vaccinatie na een chirurgische behandeling (LEEP; Loop Electrosurgical Excision Procedure) recidiverende voorloperstadia van baarmoederhalskanker vermindert.
HPV-vaccinatie binnen het RVP
In 2008 heeft de Gezondheidsraad advies uitgebracht en geadviseerd HPV-vaccinatie ter preventie van baarmoederhalskanker op te nemen in het Rijksvaccinatieprogramma.[20] Na een inhaalcampagne in 2009 voor meisjes uit de geboortecohorten 1993 t/m 1996, worden meisjes sinds 2010 uitgenodigd voor vaccinatie in het jaar dat zij 13 worden. Zowel bij de inhaalcampagne als in het reguliere vaccinatieprogramma is tot nu toe gebruikgemaakt van het bivalente HPV-vaccin. In eerste instantie kregen meisjes drie doses aangeboden, maar naar aanleiding van het advies van de EMA is dit in 2014 aangepast naar twee doses. Meisjes uit geboortecohort 2001 waren hiermee de eersten die in aanmerking kwamen voor vaccinatie met twee doses (0, 6 maanden).
Monitoring van de HPV-vaccinatiegraad en veiligheid
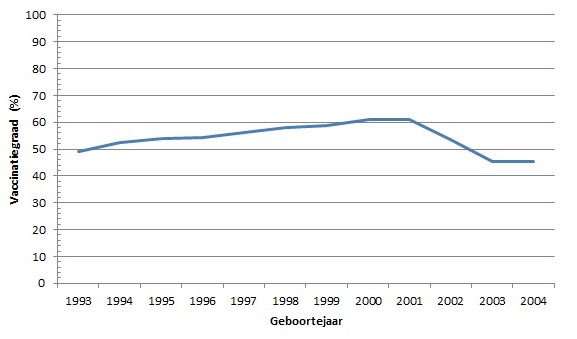
Sinds de invoering van de HPV-vaccinatie in het RVP in 2010 is de uptake een kritische factor gebleken. Hoewel de vaccinatiegraad de eerste jaren stijgende was (van 56 procent in 2010 naar 61 procent in 2013/14), heeft zich de afgelopen jaren een vrij abrupte daling voorgedaan. De vaccinatiegraad kwam daarmee voor 2016 (geboortecohort 2003) en 2017 (geboortecohort 2004) uit op 45,5 procent (figuur 2). Voorlopige cijfers laten een lichte stijging zien voor 2018, die mogelijk gerelateerd is aan de grootschalige meningokokkenvaccinatiecampagne onder jongeren en/of aan de toenemende aandacht voor vaccinatiebereidheid in de media in het algemeen.
Onderzoek onder ouders van meisjes die in aanmerking kwamen voor vaccinatie maar zich niet lieten vaccineren, toonde aan dat zij zorgen hadden over de veiligheid van dit vaccin.[21] Ook in andere landen, waaronder Denemarken en Ierland, werd een sterke daling gezien van de vaccinatiegraad. Deze daling werd vooral ingegeven door veiligheidsoverwegingen van ouders en door media-aandacht daarvoor. Na onder andere een actiever social mediabeleid vanuit het Ierse Nationaal Immunisatie Bureau, het oprichten van een HPV-vaccinatie-alliantie en een uitgebreide mediacampagne nam de bereidheid om te vaccineren in Ierland weer toe.[22]
In Nederland worden de veiligheid en de mogelijke bijwerkingen van HPV-vaccinatie continu gemonitord. Hierover is recent een overzichtsartikel verschenen van Schurink-van ‘t Klooster et al. [23] Het veiligheidsprofiel in Nederland is in lijn met dat wat in buitenlands onderzoek wordt geobserveerd. Er treden milde, voorbijgaande klachten op na de vaccinatie waarbij pijn op de injectieplaats, spierpijn en verminderd gebruik van de arm het meest frequent worden gerapporteerd. In overeenstemming met buitenlandse studies is geen associatie tussen HPV-vaccinatie en eerder gesuggereerde bijwerkingen gevonden, zoals langdurige vermoeidheidsklachten.[24]
Vaccineffectiviteit
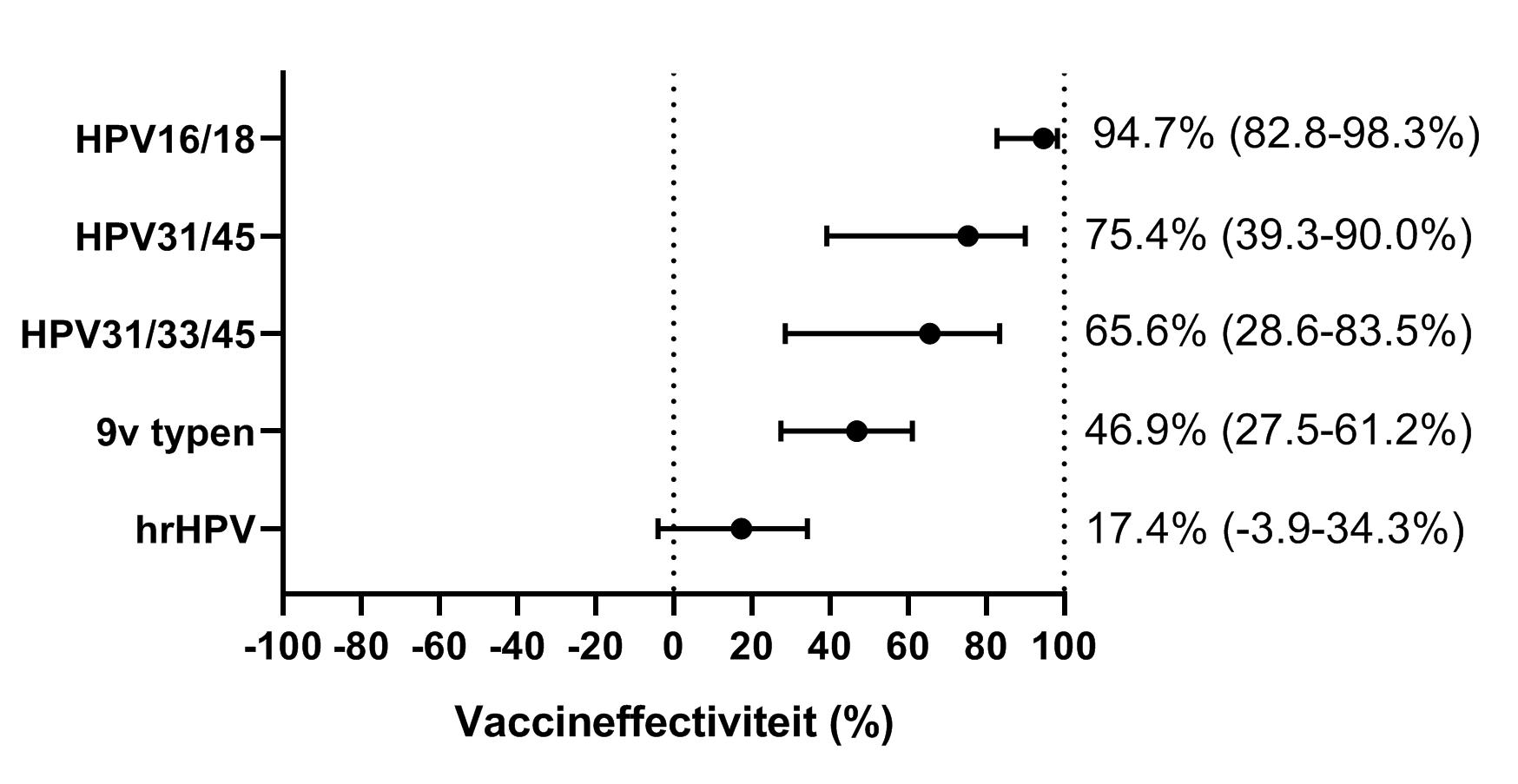
De lange periode tussen infectie en de ontwikkeling van (pre)kankerlaesies maakt dat de vaccineffectiviteit (VE) tegen kanker pas vele jaren na de start van het vaccinatieprogramma kan worden aangetoond. In de tussentijd vormt de VE tegen aanhoudende infecties een goede graadmeter (intermediate endpoint). Daarom is met de implementatie van de HPV-vaccinatie een Nederlandse prospectieve cohortstudie gestart gericht op het monitoren van de HPV-incidentie in gevaccineerde en ongevaccineerde groepen. Meisjes die in aanmerking kwamen voor HPV-vaccinatie in de inhaalcampagne (geboortecohorten 1993-1994) werden in 2009 en 2010 uitgenodigd voor deelname aan de HAVANA-studie: HPV Among Vaccinated And Non-vaccinated Adolescents. Eenmaal vóór eventuele vaccinatie en ieder jaar daarna leverden de deelneemsters een cervixborstel in waaruit de HPV-infectiestatus op typeniveau werd bepaald en vulden zij een vragenlijst in.[25] Uit deze studie blijkt dat de VE zeer hoog is; er werd een VE van 95 procent tegen persisterende infecties met vaccintypen HPV16/18 gezien tot in ieder geval zeven jaar na vaccinatie (figuur 3). Ook werd significante kruisbescherming gevonden tegen persisterende HPV31/33/45 infecties (66 procent).[11,26]
Tevens is op basis van de HAVANA-data aangetoond dat kortdurende en persistente infecties met HPV16/18 die optreden bij gevaccineerde personen een significant lagere virale load hebben in vergelijking met HPV16/18-infecties bij niet-gevaccineerde personen. Voor infecties met HPV31/45, waar kruisbescherming tegen is gevonden, werd geen lagere virale load gevonden bij gevaccineerde ten opzichte van ongevaccineerde personen. Hoewel de mechanismen van de adaptieve immuniteit op dit moment nog niet duidelijk zijn, suggereert dit dat vaccinatie de kans op langdurende infectie met HPV16/18 zou kunnen verkleinen en ook dat het effect van vaccinatie verder gaat in het beheersen van de infectie na acquisitie.[27]
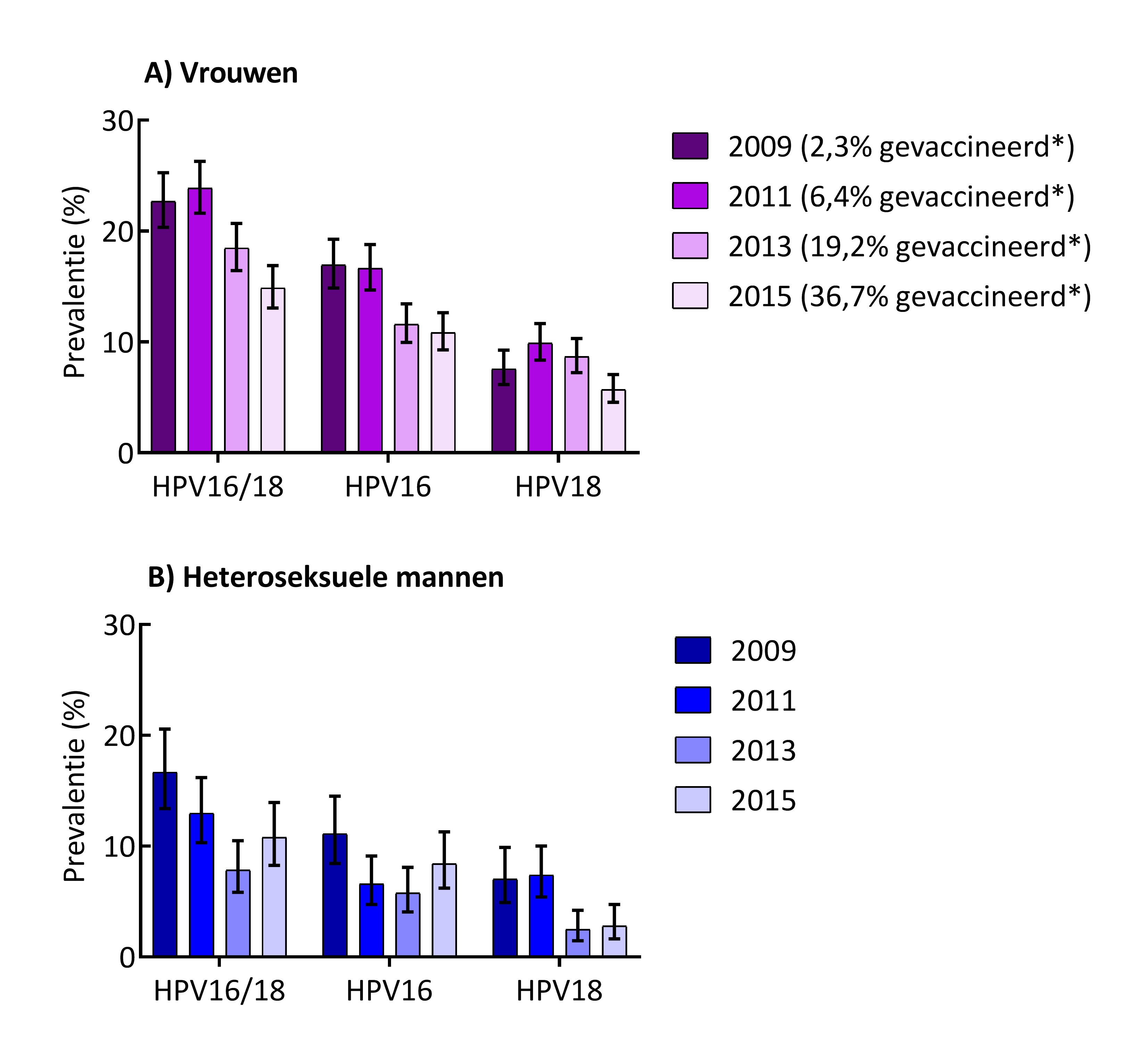
Ook in ander Nederlands, crosssectioneel onderzoek toonde men de hoge effectiviteit van het bivalente vaccin aan, onder 16- tot 24-jarige bezoekers van centra seksuele gezondheid (voormalig soa-poli’s).[28] In de PASSYON-studie (PApillomavirus Surveillance among STI clinic YOungsters in the Netherlands) daalde de HPV16/18-prevalentie onder alle deelnemende vrouwen van 23 procent voor introductie van vaccinatie in 2009 naar 15 procent in 2015. Ook onder heteroseksuele mannen was een daling zichtbaar (van 17 procent naar 11 procent), wat wijst op groepsbescherming.[29] Daarnaast kon binnen dit onderzoek een VE tegen anale HPV-infecties bij vrouwen worden berekend; hieruit bleek dat de VE tegen anale HPV16/18-infecties 90 procent is, wat een vergelijkbare effectiviteit van het vaccin suggereert als tegen genitale infecties.[30] Tevens is aan de hand van PASSYON-data gekeken naar de relatie tussen type-specifieke VE tegen niet-vaccin-hrHPV-typen en fylogenetische afstand tot HPV16/18. Hieruit bleek dat kruisbescherming tegen hrHPV beter verklaard kon worden aan de hand van genomische afstand tot HPV16/18 (zoals bepaald met whole genome sequencing) dan aan de hand van de afstand gebaseerd op L1-manteleiwitten. Hiermee kan worden gekeken naar de verschillende hoogrisicotypen HPV waarvoor wel of geen kruisbescherming kan worden verwacht op basis van de fylogenie.[31]
Ook in een recente systematische review en meta-analyse met 60 miljoen personen kwam het positieve effect van de introductie van HPV-vaccinatieprogramma’s duidelijk naar voren; acht jaar na invoering van het bivalente en quadrivalente vaccin kwamen HPV16/18-infecties 83 procent en HPV31/33/45-infecties 54 procent minder voor onder meisjes van 13 tot 19 jaar. Daarnaast was de prevalentie van CIN2-laesies sterk gedaald en was er sprake van een vermindering van genitale wratten bij zowel mannen als vrouwen.[32]
Serologie
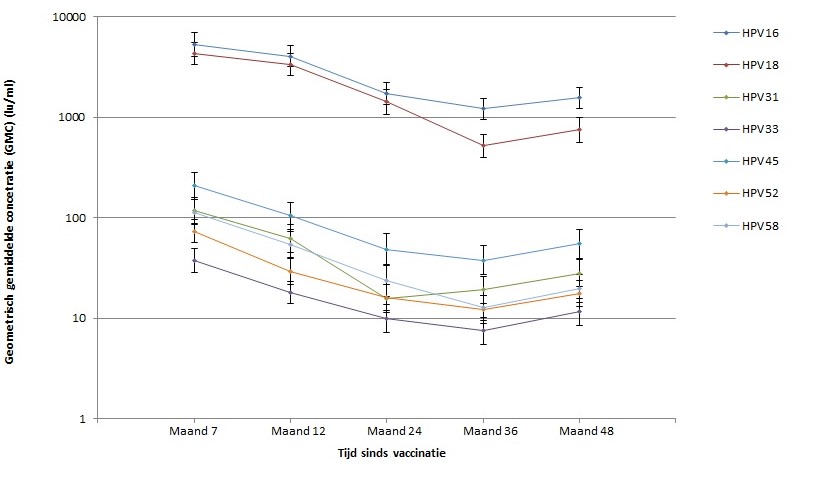
Uit verschillende monitoringsstudies is gebleken dat de immunogeniciteit van het bivalente vaccin zeer hoog is. Zowel gegevens uit de HAVANA-studie (deelneemsters gevaccineerd met drie doses in de catch-upcampagne) als uit de zogeheten HPV2D-studie (deelneemsters gevaccineerd met twee doses binnen reguliere programma) laten hoge antistofresponsen zien tegen vaccintypen HPV16/18 tot respectievelijk negen en vier jaar na vaccinatie. Ook na één dosis is het vaccin immunogeen, maar zowel de antistofconcentraties als de B- en T-celresponsen zijn lager.[33]
Karakterisering van HPV16/18
Recente karaktersering van de DNA-sequentie van het hele genoom van HPV16/18-virussen die bij Nederlandse vrouwen voorkomen, heeft geleid tot nieuwe inzichten in genoomdiversiteit van deze virussen. Er blijkt een grote populatie van HPV16/18-varianten virussen natuurlijk voor te komen bij vrouwen. Op het niveau van het gehele genoom blijkt binnen deze studies bijna iedere vrouw een unieke HPV16- of HPV18-variant te hebben.[34,35] Daarnaast is bij vrouwen met een langdurige HPV16/18-infectie de hele genoomvariantsequentie tot drie jaar na de infectie volledig identiek. Hoe deze enorme virusdiversiteit ontstaat is nog niet duidelijk. Deze bevinding maakt het echter mogelijk om onderscheid te maken tussen primaire en terugkerende HPV16/18-infecties die bijvoorbeeld CIN2/3-laesies veroorzaken.[36]
Langetermijnprojectie op ziektelast
De langetermijneffecten van vaccinatie zijn geschat aan de hand van wiskundige modellen waarmee zowel de verspreiding van het virus als de ontwikkeling van kanker werden gesimuleerd. Twee onafhankelijke studies voorspelden een halvering van de incidentie van baarmoederhalskanker bij een min of meer constante vaccinatiegraad van 50 tot 60 procent onder meisjes.[37,38] Bij deze vaccinatiegraad zou de HPV-gerelateerde ziektelast bij mannen met ongeveer een derde afnemen. Interessant is dat het indirecte effect van meisjesvaccinatie volgens modelberekeningen sterker uitvalt bij heteroseksuele mannen dan bij ongevaccineerde vrouwen.[39] Dit is te verklaren doordat indirecte bescherming van ongevaccineerde vrouwen een afspiegeling is van de indirecte bescherming van ongevaccineerde mannen (eerste-orde-effect), en derhalve een tweede-orde-effect is. Deze modelvoorspelling strookt met recente bevindingen in de PASSYON-studie.[29] Hierin is wel een daling van HPV16/18-prevalentie onder heteroseksuele mannen te zien, maar (nog) niet onder ongevaccineerde vrouwen.
Efficiëntie van seksespecifieke vaccinatie
Een andere bevinding van modelstudies is dat het verhogen van de vaccinatiegraad onder meisjes een verhoudingsgewijs sterker effect heeft op het voorkomen van HPV-infectie, en daarmee op preventie van HPV-gerelateerde ziekte, dan vaccinatie van jongens.[39] Niettemin is deze asymmetrie mild: voor elk extra meisje zouden twee jongens moeten worden gevaccineerd om een gelijke gezondheidswinst te behalen.[40] Daarnaast wordt de relatieve efficiëntie van beide strategieën ook bepaald door de moeite die het kost om extra meisjes dan wel jongens te includeren.[41] Een gecombineerde strategie biedt meer mogelijkheden op het elimineren van vaccintypen: bij meisjesvaccinatie zou de vaccinatiegraad meer dan 90 tot 95 procent moeten zijn om eliminatie van HPV16 te bereiken, maar bij sekseneutrale vaccinatie is dit volgens modellen mogelijk bij 80 procent onder zowel jongens als meisjes.[42]
Vaccinatie en screening
In 2023 stromen de eerste gevaccineerde cohorten uit de catch-upcampagne het bevolkingsonderzoek baarmoederhalskanker (BVO) in. Dit biedt de mogelijkheid om het effect van vaccinatie te meten in (pre)kankerlaesies, aangezien er dan informatie beschikbaar zal zijn over zowel vaccinatiestatus als screeningsresultaat. Dat de gunstige resultaten van bescherming tegen persisterende HPV-infectie zullen resulteren in een goede bescherming tegen voorloperstadia van baarmoederhalskanker, toont onder meer recent onderzoek in Schotland aan. Hierin werden de eerste screeningsuitslagen van (bivalent) gevaccineerde en ongevaccineerde 20-jarige vrouwen vergeleken en bleek dat onder gevaccineerden het voorkomen van CIN3, CIN2 en CIN1 met respectievelijk 89 procent, 88 procent en 79 procent was afgenomen.[43] Toch tonen dergelijke resultaten naast de positieve effecten van vaccinatie, ook de noodzaak van een continue evaluatie van het screeningsprogramma aan. Dit dient optimaal ingericht te zijn, zowel vanuit kosteneffectiviteitsoverweging als om reeds gevaccineerde vrouwen gemotiveerd te houden voor deelname.
Toekomstig perspectief
Medio 2019 heeft de Gezondheidsraad een update op haar eerdere advies uitgebracht.[44] Hierin wordt geadviseerd om naast meisjes ook jongens te vaccineren tegen HPV, om zodoende ook hun bescherming te bieden tegen de verschillende HPV-gerelateerde (voorloperstadia van) kanker. De ziektelast die kan worden veroorzaakt door een HPV-infectie bij mannen bestaat uit peniskanker, anuskanker en mond- en keelholtekanker. De vaccinatie zou aangeboden moeten worden rond het negende levensjaar, omdat is gebleken dat het vaccin langdurige bescherming biedt en om de kans dat er gevaccineerd wordt voor het seksueel debuut te vergroten. Daarnaast kan de mogelijkheid tot het combineren van de HPV-vaccinatie met de BMR- en DTP-vaccinatie die al op deze leeftijd worden aangeboden, leiden tot hogere deelname.
Volgens de Gezondheidsraad zal genderneutrale vaccinatie ervoor zorgen dat de transmissie van HPV in de populatie omlaag gaat en er grotere groepsbescherming mogelijk is, waarmee ook mannen die seks hebben met mannen (MSM) en ongevaccineerde meisjes beter beschermd zijn.[45] Tevens is de kosteneffectiviteitsratio van sekseneutrale vaccinatie zoals berekend onder de huidige omstandigheden, lager dan de gebruikte referentiewaarde van € 20.000 per Quality-Adjusted Life Year (QALY).[40] Dit gegeven gecombineerd met de veiligheid en effectiviteit van de vaccins maakt de belasting voor zowel het individu als het RVP als geheel aanvaardbaar, waarbij aanvaardbaarheid bepaald wordt door de verhouding tussen nut en risico van de vaccinatie. Ten slotte adviseerde de Gezondheidsraad om mensen tot en met 26 jaar de mogelijkheid te bieden zich alsnog te laten vaccineren tegen HPV via een aanvullend vaccinatieprogramma. In september 2019 werd duidelijk dat de minister van Volksgezondheid, Welzijn en Sport het advies van de Gezondheidsraad volgt; het streven is om vanaf 2021 te starten met het aangepaste programma.
Conclusie
Tien jaar na de invoering van de HPV-vaccinatie blijkt uit vele nationale en internationale onderzoeken dat de effectiviteit van HPV-vaccinatie hoog en langdurig is en dat het vaccin veilig is. Hiermee heeft HPV-vaccinatie de potentie om een belangrijke rol te spelen in de preventie van verschillende HPV-gerelateerde kankers bij zowel mannen als vrouwen. De toenemende bewijzen voor effectiviteit tegen (voorloperstadia van) kanker en de geplande wijzigingen in het vaccinatieprogramma kunnen bijdragen aan het verbeteren van de vaccinatie-uptake en daarmee aan het verminderen van de totale HPV-gerelateerde ziektelast.