Samenvatting
Cytomegalovirus (CMV)-reactivatie veroorzaakt directe cytopathologische effecten in verschillende organen en heeft tevens indirecte immuunmodulerende effecten. Deze effecten zijn welomschreven bij patiënten na een orgaan- of stamceltransplantatie. CMV-reactivatie blijkt echter ook op te treden bij 14 tot 71 procent van voorheen immuuncompetente intensivecare (IC)-patiënten. Hoewel er nog geen definitief bewijs is voor CMV-pathogeniciteit bij IC-patiënten, blijkt uit klinisch-observationele studies dat CMV-reactivatie geassocieerd is met een langere beademings- en ligduur. Bovendien wordt in de grotere observationele studies een onafhankelijke associatie met mortaliteit gevonden. Dit heeft geleid tot gerandomiseerde fase II-studies die de effecten van antivirale behandeling tegen CMV hebben bestudeerd. Hieruit blijkt dat profylactisch ganciclovir effectief is in het voorkomen van CMV-reactivatie en dat de bijwerkingen van ganciclovir beperkt zijn. Fase III-gerandomiseerde studies zijn nodig om de toegevoegde waarde te bepalen van profylactische en preëmptieve antivirale behandeling. Vooralsnog wordt routinematige antivirale behandeling bij IC-patiënten afgeraden. Echter in specifieke casuïstiek kan men overwegen om diagnostiek naar CMV-reactivatie te verrichten en antivirale behandeling te beginnen. In dit artikel wordt een overzicht gegeven van de laatste inzichten in CMV-reactivatie bij voorheen immuuncompetente IC-patiënten.
Abstract
Cytomegalovirus (CMV) reactivation may cause direct cytopathologic effects in many organs and initiate indirect immunomodulating effects. These effects are mainly known in patients after solid organ- or stem cell transplantation. Interestingly, CMV reactivation also occurs in 14 to 71 percent of previously immunocompetent intensive care unit (ICU) patients. A final proof of CMV pathogenicity in ICU patients is lacking, but many clinical observational studies show that CMV reactivation is associated with prolonged mechanical ventilation and ICU stay. Moreover, in the larger and adequately powered observational studies an independent association with increased mortality was found. These findings led to phase II randomized controlled trials with antiviral treatment for the prevention of CMV reactivation. These proof-of-concept studies showed that prophylactic ganciclovir was effective in reducing the rate of CMV reactivation in plasma and ganciclovir appeared to be safe with regards to adverse effects. Phase III randomized controlled trials are necessary to determine the effectiveness of prophylactic and preemptive antiviral treatment on clinical endpoints. Based on current available evidence routine clinical use of antiviral treatment cannot be recommended in ICU patients. However, in specific cases diagnostics and treatment for CMV may be considered. This review provides an overview of the latest findings on CMV reactivation in previously immunocompetent ICU patients.
Inleiding
Het cytomegalovirus (CMV) is een dubbelstrengs DNA-virus behorende tot de groep van bètaherpesvirussen. Meestal vindt de primaire infectie met CMV plaats gedurende de kinderleeftijd of adolescentie, waarna het virus latent in de gastheer aanwezig blijft. De CMV-seroprevalentie neemt toe van 50 procent bij jongvolwassenen tot 90 procent bij oudere volwassenen.1,2 Wanneer het immuunsysteem verminderd is, krijgt CMV de kans om te reactiveren.
Bij patiënten die een orgaan- of stamceltransplantatie hebben ondergaan en bij patiënten met hiv-infectie openbaart een CMV-infectie zich voornamelijk door cytopathologische effecten in organen.2 Doordat CMV geïnfecteerde gastheercellen vergroot en intranucleaire insluitsels veroorzaakt die omgeven worden door een halo, ontstaan er de klassieke ‘uilenogen’ die in histopathologische preparaten waarneembaar zijn. Naast deze directe effecten heeft CMV ook immuunmodulerende effecten; zowel weefselschade door een overmatige pro-inflammatoire reactie als een verhoogd risico op meer opportunistische bacteriële en fungale infecties door een toegenomen anti-inflammatoire reactie.3 Om deze pathologische effecten te voorkomen, is profylactische of preëmptieve antivirale therapie dan ook de standaardbehandeling geworden voor deze klassieke groep van immuungecompromitteerde patiënten.4,5
CMV-reactivatie komt echter ook voor bij andere patiëntengroepen. De afgelopen twee decennia is in een groeiend aantal studies het optreden van CMV-reactivatie beschreven bij intensivecare (IC)-patiënten. Toch worden IC-patiënten over het algemeen niet beschouwd als immuungecompromitteerd en wordt er meestal niet gedacht aan eventuele opportunistische infecties door virale verwekkers.
IC-patiënten met een verhoogd risico op CMV-reactivatie
Bij volwassen IC-patiënten betreft het bijna altijd CMV-reactivatie en geen primaire infectie als onderliggende mechanisme van een aangetoonde viremie of een viral load in de lagere luchtwegen.6-11 Er zijn diverse risicofactoren voor CMV-reactivatie bekend, waaronder ‘acute respiratory distress’-syndroom (ARDS), sepsis en ernstige brandwonden. In open longbiopten van 100 patiënten met een ARDS zonder respiratoire verbetering na vier dagen en waarin geen bacteriële verwekker was aangetoond, werden bij 30 procent van deze voorheen immuuncompetente patiënten de karakteristieke CMV-‘uilenogen’ in histologische biopten gezien.12 Daarnaast is in een experiment met immuuncompetente muizen geobserveerd dat CMV-reactivatie een exacerbatie van cytokine- en chemokine-expressie in het longweefsel veroorzaakte, wat vervolgens resulteerde in longfibrose.13 Wanneer er vervolgens op gerandomiseerde wijze profylactisch ganciclovir werd toegediend, was ganciclovir effectief in het voorkomen van CMV-reactivatie en de ontwikkeling van deze pulmonale fibrose. Naast ARDS is het klinisch beeld van sepsis een veelvoorkomende indicatie voor IC-opname. Tijdens sepsis ondergaat het immuunsysteem dynamische veranderingen, met als gevolg dat virussen kunnen reactiveren.14,15 Hierdoor wordt virusreactivatie veelal als een marker van het immuunsysteem gezien.9 Omgekeerd zouden de immuunmodulerende effecten van CMV ook een rol kunnen spelen in de pathogeniciteit van CMV.9,16,17 Ook bij patiënten met ernstige brandwonden komt CMV-reactivatie opmerkelijk vaak voor.8,18
Belangrijkste bevindingen uit klinische observationele studies
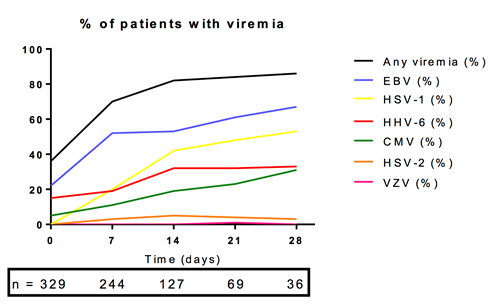
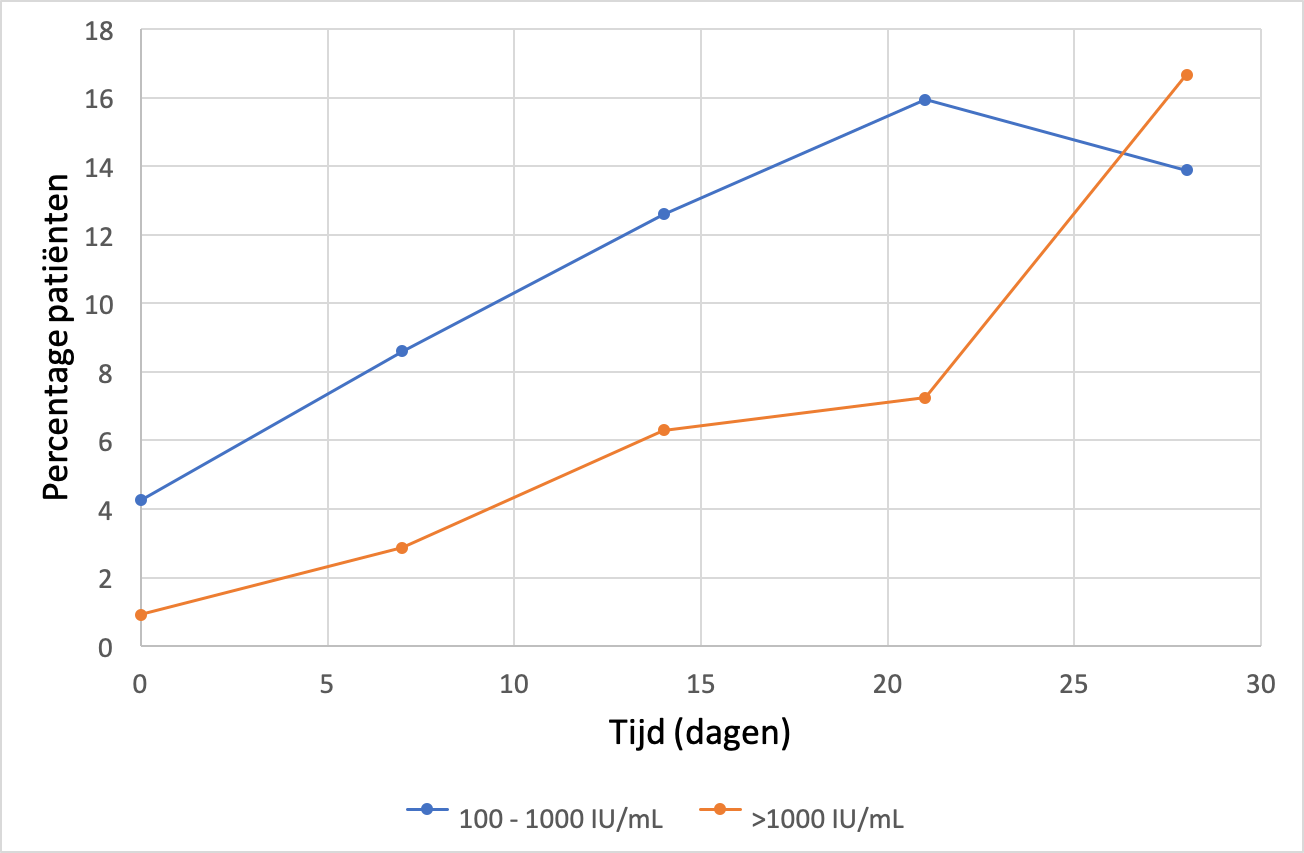
CMV-reactivatie blijkt bij 14 tot 71 procent van voorheen immuuncompetente IC-patiënten op te treden en is geassocieerd met een langere beademings- en/of IC-ligduur (tabel 1, zie aan het eind van het artikel).6-8,10,18-27 In de grotere studies is zelfs een onafhankelijke associatie met mortaliteit aangetoond.6,7,9-11,18,20,24,25,27 In de grootste observationele studie waarin gecorrigeerd werd voor de ernst van ziekte in de analyse, droeg CMV-reactivatie bij aan de toegenomen mortaliteit van patiënten met ARDS.27 Op basis van mathematische modellen bleek dat de absolute 30-dagenmortaliteit met 4,4 procent (95% BI 1,1-7,9%) verhoogd werd door CMV-reactivatie. Bij patiënten met septische shock waren ook andere herpesvirussen, zoals epstein-barrvirus (EBV), humane herpesvirus-6 (HHV-6) of herpessimplexvirus (HSV) aantoonbaar in het bloed van 68 procent van de patiënten.11 Uit uitgebreide multivariabele analyse van deze gegevens bleek dat enkel gecombineerde CMV- en EBV-reactivatie onafhankelijk geassocieerd is met toegenomen mortaliteit bij patiënten met een septische shock, terwijl reactivaties met andere herpesvirussen niet onafhankelijk geassocieerd waren met een verhoogde mortaliteit. In deze laatstgenoemde studie had meer dan 80 procent van de patiënten die vier weken of langer op de IC lagen een viremie met een of meer herpesvirussen (figuur 1). Op populatieniveau steeg ook de CMV-load gedurende de IC-opname (figuur 2).
Bovenstaande observaties komen overeen met bevindingen uit andere studies waarbij is gebleken dat de gemeten CMV-load in het bloedplasma van IC-patiënten vaak onder de 1000 IU/ml ligt gedurende de eerste twee weken van IC-opname. Uit de huidige data is geen harde afkapwaarde voor de viral load af te leiden voor een betrouwbare vertaling naar klinische relevantie.
De relatie tussen systemische reactivatie in het bloed en lokale reactivatie in bijvoorbeeld de longen is ook nog onvoldoende opgehelderd. De meeste studies hebben de viral load in het bloed onderzocht en op basis van deze studies is de onafhankelijke associatie met morbiditeit en mortaliteit geconstateerd.
Gerandomiseerde studies met antivirale behandeling
Er zijn tot op heden twee gerandomiseerde klinische studies gepubliceerd die de effecten van antivirale behandeling tegen CMV hebben bestudeerd bij IC-patiënten (tabel 2).28,29Aangezien ganciclovir geassocieerd is met beenmergtoxiciteit zou deze bijwerking nadelige gevolgen kunnen hebben voor IC-patiënten, die al instabiel zijn wegens hun ernstige acute ziekte. De twee gerandomiseerde studies beoogden dan ook om meer informatie te verschaffen over de werkzaamheid van antivirale therapie tegen CMV-reactivatie, de veiligheid van antivirale therapie en de haalbaarheid van een grotere fase III-studie. Omdat deze trials dus proof-of-conceptstudies waren (fase II-studies), zijn er geen klinische uitkomsten gebruikt als primaire eindpunten.
In de eerste studie werd profylactisch ganciclovir in een groep van 84 CMV-seropositieve patiënten met sepsis, trauma of ARDS vergeleken met placebo in een controlearm van 72 patiënten.28 Ganciclovir was effectief in het voorkomen van CMV-reactivatie: 12 procent in de ganciclovir-groep versus 39 procent in de placebogroep (p < 0.001). Bovendien was er geen verschil in bijwerkingen tussen beide groepen en ontstond er bij geen enkele patiënt neutropenie. Een belangrijke kanttekening was echter dat het gemiddeld drie dagen duurde voordat de CMV-seropositiviteituitslag bekend werd in de centra die hebben meegedaan in de studie, waardoor met ganciclovir-profylaxe vertraagd werd begonnen, hetgeen er waarschijnlijk toe heeft bijgedragen dat bij 6 procent van de geïncludeerde patiënten CMV-reactivatie al begonnen was op het moment van randomisatie. Ten slotte was de studie niet groot genoeg om een eventueel verschil in mortaliteit aan te kunnen tonen. Wel was er een significante verkorting van de beademingsduur in de ganciclovir-groep ten opzichte van de placebogroep, wat zou kunnen passen bij de hypothese dat ganciclovir door het voorkomen of reduceren van CMV-reactivatie de overmatige pro-inflammatoire reactie in de longen vermindert.
Het tweede gerandomiseerde onderzoek betrof een vergelijking tussen drie studie-armen: 34 patiënten met valaciclovir versus 46 met valganciclovir versus 44 met placebo.29 Opmerkelijk was dat de behandelarm met valaciclovir vroegtijdig werd gestopt vanwege een onverwachte verhoogde mortaliteit geconstateerd in de interimanalyse. Daarentegen was ganciclovir effectief in het reduceren van CMV-reactivatie van 35 procent naar 3 procent en er was geen verschil in neutropenie of trombocy-topenie in vergelijking met de placebogroep.
Bovengenoemde twee studies laten zien dat profylactisch ganciclovir effectief is in het voorkomen van CMV-reactivatie en dat de bijwerkingen van ganciclovir beperkt lijken te zijn in deze studiepopulatie voor zover beoordeelbaar in fase II-studies. Dit maakt de weg vrij voor de volgende stap om in fase III-studies de effecten van antivirale profylaxe op klinisch relevante eindpunten te bestuderen.
Op dit moment is er één lopende gerandomiseerde studie die in tegenstelling tot de eerdergenoemde studies een preëmptieve strategie onderzoekt [PTH trial NCT02152358]. In deze studie worden patiënten die langer dan vier dagen mechanisch beademd worden, en een CMV-load hoger dan 500 IU/ml in het bloed of een positieve PCR op HSV in de orofarynx vertonen, gerandomiseerd in vier studiearmen: (1) ganciclovir (2) placebo voor ganciclovir (3) aciclovir en (4) placebo voor aciclovir. De primaire uitkomst van de studie is een gecombineerd eindpunt van mechanische beademingsduur en mortaliteit. Er is gekozen voor een dergelijk gecombineerd eindpunt, omdat er anders een veel grotere studiepopulatie nodig zou zijn voor het kunnen aantonen van een verschil in mortaliteit. Tevens is gekozen voor een preëmptieve strategie, omdat de meerderheid van patiënten geen CMV-reactivatie laat zien, waardoor voor het evalueren van een profylactische strategie veel meer patiënten nodig zijn.30,31
Een vertaling voor de klinische praktijk
Voor de vertaling van deze onderzoeksresultaten naar de praktijk is het belangrijk om twee vragen van elkaar te onderscheiden: (a) veroorzaakt CMV-reactivatie een slechtere prognose bij IC-patiënten? en (b) is profylactische of preëmptieve antivirale behandeling effectief in het reduceren van morbiditeit en mortaliteit bij IC-patiënten? De eerste betreft een etiologische vraag. Aangezien CMV-reactivatie niet te randomiseren is, is men voor het beantwoorden van deze vraag afhankelijk van observationeel-klinisch, translationeel en fundamenteel onderzoek. De tweede vraag gaat over de pragmatische toepassing van antivirale medicatie in de klinische praktijk, wat wel onderzocht kan worden in een gerandomiseerde setting. Indien er geen verschil gevonden wordt tussen de behandel- en controlegroep betekent dit niet dat een oorzakelijk verband is uitgesloten. De geobserveerde klinische eindpunten zijn namelijk het resultaat van zowel de effectiviteit van het geteste antivirale middel (die niet 100 procent is) als de eventuele negatieve effecten die het middel veroorzaakt. Daarnaast is het uiteraard afhankelijk van het type patiënten dat geïncludeerd wordt in de studie. Hierdoor is het mogelijk dat huidige interventies om CMV-reactivatie te voorkomen niet tot een gezondheidswinst leiden, terwijl CMV wel etiologisch gerelateerd is aan een slechtere uitkomst.
Een profylactische strategie op basis van CMV-seropositiviteit in combinatie met eenvoudige klinische criteria heeft het voordeel dat deze niet afhankelijk is van de mogelijkheid tot frequente monitoring op de aanwezigheid van CMV in het bloed. Een tweede voordeel is dat antivirale therapie gestart wordt in een zo vroeg mogelijk stadium, wat hoogstwaarschijnlijk de effectiviteit verhoogt. Een belangrijk nadeel is dat bij 60 tot 75 procent van de IC-patiënten geen CMV-reactivatie zal optreden, zelfs in een situatie zonder antivirale profylaxe, en dat de meerderheid onnodig wordt blootgesteld aan antivirale medicatie. Bij een preëmptieve benadering wordt eerst getest of een viral load detecteerbaar is in het bloed (of eventueel in de lagere luchtwegen), voordat antivirale behandeling gestart wordt. Deze strategie heeft het voordeel dat onnodige blootstelling aan ganciclovir wordt voorkomen bij patiënten bij wie geen CMV-reactivatie optreedt. Een nadeel is dat therapie pas laat gestart wordt, als CMV-reactivatie al is begonnen.
Vanwege de veronderstelling onder vele professionals dat CMV-reactivatie alleen bij de klassiek gelabelde immuungecompromitteerden relevant is, wordt er niet routinematig diagnostiek naar CMV in het bloed of de longen van IC-patiënten uitgevoerd. Enerzijds is dit begrijpelijk omdat er geen absolute zekerheid bestaat dat CMV-reactivatie meer dan alleen een marker is van een verminderd immuunsysteem of ernst van ziekte. Anderzijds is het echter onhoudbaar om te beweren dat een rol van CMV-reactivatie in voorheen immuuncompetente IC-patiënten uitgesloten is wanneer gekeken wordt naar de toenemende aanwijzingen uit verschillende studies voor CMV-pathogeniciteit.
Als volgende stap zijn gerandomiseerde fase III-studies nodig om de toegevoegde waarde van profylactische of preëmptieve antivirale behandeling bij IC-patiënten te verduidelijken. Op dit moment kan op basis van klinische risicofactoren (bijvoorbeeld langdurige mechanische beademing in combinatie met een ARDS of klinische verdenking op sepsis) een studiepopulatie geselecteerd worden met een risico op CMV-reactivatie van ongeveer 25 tot 40 procent. De grootste uitdaging voor een gerandomiseerde studie die een profylactische antivirale strategie evalueert, ligt daarom in de vereiste studiegrootte. Dit zal afnemen wanneer op basis van bijvoorbeeld de combinatie van klinische risicofactoren en misschien aanvullende biomarkers beter voorspeld zou kunnen worden bij wie CMV-reactivatie gaat optreden. Totdat dit mogelijk is, lijkt een preëmptieve strategie vooralsnog het meest voor de hand te liggen, maar dit vereist in ieder geval de beschikbaarheid van een optimaal logistiek proces, waarbij moleculaire diagnostiek op regelmatige basis verricht kan worden. Er zijn tevens meer studies nodig die specifiek de pathologische mechanismen van CMV bij IC-patiënten verder ontrafelen. Hopelijk kunnen in de nabije toekomst veel specifiekere subgroepen binnen de heterogene groep geïdentificeerd worden, waarin CMV-reactivatie in een veel hoger percentage optreedt en de meeste nadelige effecten veroorzaakt. Kortom, het zou interessant zijn om een nog specifiekere groep te kunnen identificeren, waarin het grootste voordeel gehaald zou kunnen worden met antivirale behandeling.
Conclusie en aanbeveling
Hoewel er geen definitief bewijs is voor CMV-pathogeniciteit bij voorheen immuuncompetente IC-patiënten zijn er veel studies die dit suggereren. Aangezien gerandomiseerde fase III-studies nog ontbreken, wordt routinematige profylactische of preëmptieve behandeling met antivirale medicatie zoals ganciclovir afgeraden. In specifieke casuïstiek kan echter overwogen worden om diagnostiek naar CMV-reactivatie in het bloed en in de longen te verrichten. Hierbij moet men vooral denken aan IC-patiënten met langdurig respiratoir falen in de aanwezigheid van pulmonaire infiltraten, waarbij bacteriële kweken negatief zijn en andere verklaringen voor het klinisch beeld ontbreken. In dergelijke situaties zou bij aanwezigheid van CMV-reactivatie antivirale behandeling met ganciclovir overwogen kunnen worden mits er geen cytopenie of andere contra-indicaties aanwezig zijn.