Rede uitgesproken bij haar afscheid als hoogleraar Medische Microbiologie aan de Faculteit der Geneeskunde van de Vrije Universiteit Amsterdam op 6 oktober 2017.
Mijnheer de Rector Magnificus, Dames en Heren,
Enkele jaren geleden nam ik een nieuwe smartphone in gebruik, het eerste model met een Personal Assistant, Siri genaamd, die al je vragen zou kunnen beantwoorden. Je kan Siri op twee verschillende manieren activeren, daarna hoef je alleen “Hey Siri” te zeggen en je vraag te stellen. Ik besloot haar op beide manieren uit te proberen en stelde twee keer precies dezelfde vraag: “Hoe laat is het in Jakarta?”. Na de eerste activatie luidde het antwoord: “Het is 8u ‘s ochtends in Jakarta”. Toen ik dezelfde vraag een tweede keer stelde antwoordde Siri: “Het is 8u.01 ’s ochtends in Jakarta. Is er iets gaande daar waar ik van af zou moeten weten??”
U kunt zich voorstellen dat ik enigszins verbouwereerd naar mijn telefoon keek, verwonderd, in bewondering en nieuwsgierig naar hoe dit nou werkte. Ditzelfde gevoel van verwondering, bewondering en nieuwsgierigheid is het gevoel dat mijn vak, de medische microbiologie, steeds weer bij me oproept, het gevoel waarvan ik u in mijn oratie in maart 1996 deelgenoot probeerde te maken en waarvan ik u nu opnieuw deelgenoot wil maken - aan de hand van drie thema’s. Allereerst wil ik u een beeld schetsen van hoe ongelooflijk divers en flexibel micro-organismen zijn, nu niet als individuele bacteriën, maar als microbiota. Een microbiota is het geheel van micro-organismen, van ongelooflijk veel verschillende soorten, dat een specifieke omgeving bezet. In het tweede deel van mijn verhaal zal ik ingaan op hoe we dankzij technologische ontwikkelingen het ziekmakend vermogen van bacteriën steeds beter kunnen bestuderen en de diagnostiek van infectieziekten verder verbeteren. In het derde deel zal ik stil staan bij de verder toenemende resistentie van bacteriën tegen antibiotica.
I - De grenzeloze verscheidenheid van microbiota
Dat in de mond van de mens ontelbaar veel kleine levende dierkens in vele vormen aanwezig zijn werd voor het eerst waargenomen door Antoni van Leeuwenhoek. Het was 1683. Hij schreef: “Alle mensen die in de Nederlanden leven zijn samen nog kleiner in aantal dan alle levende dierkens die ik vandaag in mijn mond heb”. Er leefden toen ongeveer twee miljoen mensen in Nederland.
Inmiddels weten we dat elke specifieke omgeving zijn eigen natuurlijke microbiota kent: elk dier, plant, zee, meer, berg, ijsberg, heetwaterbron, stad, huis, ziekenhuis. En elke microbiota bevat ontelbare verschillende soorten micro-organismen. Ik zal vandaag vooral over bacteriën spreken, maar elke microbiota bevat ook schimmels, parasieten en virussen. Het vergaren van kennis over de microbiota in de natuurlijke omgeving begon met klassieke kweektechnieken en vorderde langzaam. Sprongen voorwaarts werden gemaakt met de introductie van steeds betere technieken om de volgorde van de bouwstenen van het genetisch materiaal, het DNA, in kaart te brengen. Inmiddels is het mogelijk om alle verschillende soorten bacteriën, - zelfs nieuwe soorten - te herkennen zonder ze eerst te kweken, door DNA te sequensen.
Eind vorige eeuw paste David Relman, in de VS, de DNA-analyse technieken die aanvankelijk alleen gebruikt werden om bacteriën in de omgeving te analyseren, toe bij de mens. Net als zijn beroemde voorganger van Leeuwenhoek, begon hij met het onderzoeken van de microbiota in zijn eigen mond.1 Om een lang verhaal kort te maken: inmiddels weten we dat de mens, op al zijn oppervlakken en in al zijn holtes, bevolkt is door talloze soorten bacteriën, schimmels, parasieten en virussen, die onder normale omstandigheden niet alleen in peis en vree met hem leven, maar zelfs onmisbaar zijn voor een goede gezondheid.
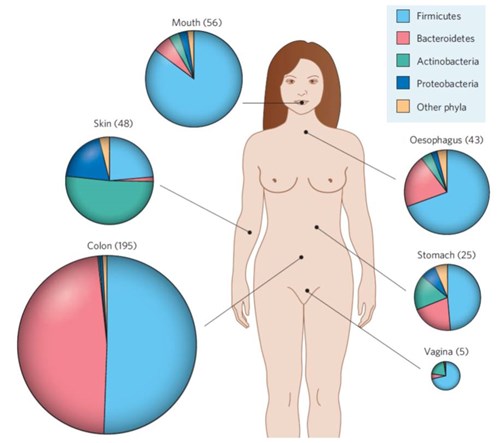
Als we kijken naar de mens en zijn microbiota, blijkt dat elke plek: de huid, de maag, de dunne darm, de dikke darm, de mond, de keel, de vagina een karakteristieke microbiota heeft met een eigen specifieke samenstelling.2 Bacteriesoorten worden ingedeeld in grote groepen: de Firmicutes, Bacteroides, Actinobacteria, Proteobacteria en nog enkele andere. Deze vier zijn de belangrijkste en komen in verschillende verhoudingen op de verschillende plaatsen voor, zoals u hier geïllustreerd ziet. Binnen elk van deze grote groepen zijn er honderden verschillende bacteriënsoorten (zie figuur 1).
In hoofdlijnen is de samenstelling van de microbiota op deze verschillende plekken dezelfde bij alle mensen, maar als je dieper inzoomt op precieze verhoudingen en samenstelling van groepen, valt op dat er veel variatie bestaat.
Die variatie komt tot stand door allerlei factoren. Zo heeft wat je eet invloed op de samenstelling van de microbiota van de darm. Mensen die veel vlees eten hebben een andere microbiota dan mensen die vooral vezelrijk eten. Dit komt omdat elke bacteriesoort zo zijn eigen eigenschappen heeft wat betreft de stoffen die zij kan omzetten. Bacteriën in onze darm helpen ons ons voedsel verteren, produceren vitamines en allerlei stoffen die in de bloedbaan opgenomen worden. Zij houden vreemde indringers buiten, door alle ruimte te bezetten en stoffen te produceren die de indringers doden. Daarnaast zijn ze van belang voor ons afweersysteem en beïnvloeden zij ons zenuwstelsel.
Is deze kennis nieuw? Nee. Reeds in 1966 beschreef René Dubos, een Franse microbioloog die tijdens de Tweede Wereldoorlog naar New York was uitgeweken, de samenstelling en functie van de darm microbiota alsof hij de hedendaagse literatuur al had gelezen.3 Dubos beschrijft de darm microbiota als een uniek ecosysteem, een “biological force” die de ontwikkeling van het maagdarmstelsel mede bepaalt. Hij beschrijft het voorkomen van ontelbare soorten en beseft dat er véél meer zijn dan men indertijd kon kweken. Dat de gehele humane microbiota een ‘biological force’ is beginnen we de laatste jaren opnieuw te herkennen.
Vijf jaar geleden was ik in Parijs op een congres, waar Stephen Collins, een Canadese internist-onderzoeker, vertelde over proeven met twee soorten muizen: Balb/c muizen en NIH Swiss muizen. Balb/c zijn van nature onderzoekende moedige muizen, terwijl Swiss muizen bang zijn van aard. Dit liet hij zien aan de hand van proeven met een lichtbox: Balb/c komen gemakkelijk uit het donker naar het licht, terwijl Swiss liever veilig in het donker blijven zitten. Ook springen de moedige muizen vaker van en plankje. Als Collins de darminhoud van de moedige muizen inbracht bij de bange muizen, dan werden deze ineens een stuk moediger en gingen vaker op onderzoek uit en sprongen vaker van hun plankje. Andersom maakte de darminhoud van de bange muizen de moedige muizen een stuk minder moedig. Deze gedragsveranderingen gaan gepaard met veranderingen in de hoeveelheid van een bepaalde stof, Brain Derived Neurotropic Factor, in de hersenen van de muizen.4 We luisterden allemaal een beetje sceptisch naar deze verhalen, maar toch, ze brachten mij hetzelfde gevoel van verbazing, verwondering en nieuwsgierigheid dat ik kreeg toen Siri mij vroeg of er iets gaande was in Jakarta.
Het onderzoek naar de samenstelling en de rol van onze microbiota wordt gedreven door de moderne technieken die het onderzoek onafhankelijk hebben gemaakt van de langzamere kweektechnieken. Binnen onze afdeling heeft Dries Budding dit onderzoek binnen handbereik gebracht door een geheel nieuwe techniek te ontwikkelen, de IS-pro, ook gebaseerd op DNA analyse, waarmee het mogelijk is om de samenstelling van ingewikkelde microbiota binnen een halve dag in kaart te brengen.5
Wereldwijd is veel van het onderzoek gericht op het ontrafelen van de samenstelling van de microbiota van gezonde mensen: oude mensen, jonge mensen, kinderen, baby’s, mensen in steden, in geïsoleerde dorpen in de Amazone, op eilanden - overal. Daarnaast neemt het onderzoek toe naar de microbiota bij verschillende ziekten: obesitas, diabetes, chronische darmziekten, astma. Telkens vindt men kenmerkende aspecten en de kennis omtrent de verschillende functies van de microbiota groeit.
Laat mij een paar voorbeelden geven. Uit verschillende onderzoeken blijkt dat sommige bacteriesoorten in onze darm geneesmiddelen afbreken of omzetten: verschillen in voorkomen van deze bacteriën tussen verschillende mensen kan helpen verklaren waarom de ene persoon goed reageert op een bepaalde therapie en de andere niet.6 Zo wordt bijvoorbeeld digoxine bij ongeveer 10 van de mensen in de darm afgebroken door een specifieke bacterie soort. Dit maakt het bepalen van de juiste dosis toe te dienen digoxine in deze groep heel moeilijk.7
Een tweede voorbeeld van nieuwe kennis omtrent de vele functies van onze darmmicrobiota is recent: in augustus jl. [2017, red.] beschreven Amerikaanse onderzoekers in Science dat sommige bacteriesoorten desaminotyrosine, of DAT, produceren. DAT zet immuuncellen aan tot type I-interferonproductie en speelt daarmee een rol in de bescherming tegen virusinfecties zoals griep. Deze bacteriën maken DAT uit flavonoïden, stoffen die in grote hoeveelheden voorkomen in groenten en fruit. Deze bevindingen zijn gedaan in muizen, maar dit soort bacteriën komt ook voor in de menselijke darm. “Hey Siri”, zou dit de wetenschappelijke verklaring zijn van het oude adagium dat groenten en fruit eten gezond is?
Critici noemen alle aandacht voor microbiota een hype en vragen zich af of alle waarnemingen oorzaak of gevolg zijn? In veel gevallen weten we dat nog niet, onderzoek naar oorzaak en gevolg is niet eenvoudig: mensen zijn geen muizen, je kan niet zomaar experimenteren en darminhoud van de ene inbrengen bij de ander en kijken wat er gebeurt. Of toch? Het onderzoek naar gevolgen van veranderingen in darm microbiota heeft nieuw elan gekregen sinds onderzoek van Els van Nood, Josbert Keller en collega’s uit het AMC liet zien dat patiënten die lijden aan steeds weerkerende diarree door een infectie met de bacterie Clostridium difficile, genezen wanneer zij feces, poep, toegediend krijgen van gezonde mensen.9 Maakt u zich geen zorgen, zij hoeven dit niet te slikken, het gaat via een sonde. De darm microbiota die totaal verstoord is bij mensen met C. difficile-infectie, krijgt weer een normale samenstelling en de diarree verdwijnt. Fecestransplantatie, in moderne termen fecale microbiotatransplantatie of kortweg FMT genaamd, is inmiddels een veelgebruikte behandeling. In VUmc zijn collega Chris Mulder en onze promovenda, Yvette van Beurden, met veel succes gestart met het toepassen van FMT, na een uitbraak van C. difficile-infecties. Inmiddels hebben we een mooie lijn van onderzoek naar mogelijke toepassingen van FMT.10-12
IIa - Het ontrafelen van het ziekteverwekkend vermogen van bacteriën
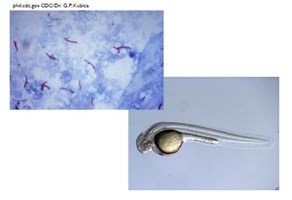
Medio 2001 besloten Wilbert Bitter, Ben Appelmelk en ik om een belangrijk deel van het onderzoek van de afdeling te richten op tuberculose, omdat er wereldwijd nog steeds jaarlijks ongeveer 10 miljoen nieuwe gevallen van deze ziekte voorkomen en omdat de verwekker, Mycobacterium tuberculosis of tuberkelbacterie, steeds resistenter wordt tegen de gangbare behandeling. Daarnaast was toen nog weinig bekend over hoe deze bijzondere bacterie precies ziekte veroorzaakt. Zij is bijzonder omdat zij heel traag groeit, zij heeft een delingstijd van 24 uur – een eeuwigheid in vergelijking met de delingstijd van 20 minuten van bijvoorbeeld Escherichia coli, een van de bacteriën uit onze darm. Zij is ook bijzonder omdat zij een hele dikke celwand heeft die haar beschermt: antibiotica en desinfectantia komen er moeilijk doorheen. Wilbert en Ben hadden een prachtig idee: laten we Mycobacterium marinum, een eerstegraads neefje van de tuberkelbacterie gebruiken en zebravis embryo’s als diermodel. Reden voor deze keuze was dat M. marinum erg lijkt op M. tuberculosis, maar veel sneller groeit en in zebravissen ziekte veroorzaakt die heel erg lijkt op tuberculose bij mensen (figuur 2).
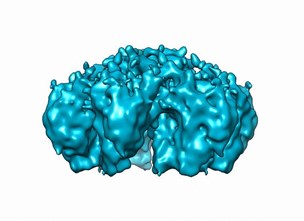
Zebravis embryo’s hebben het grote voordeel dat ze buiten de moeder groeien en doorzichtig zijn. Door de mycobacteriën met moleculair genetische technieken groen of rood fluorescerend te maken kan je onder de microscoop de gang van de bacteriën door het embryo tijdens infectie volgen. Zo kunnen we kijken wat er gebeurt als je genen in de bacterie uitschakelt: zijn die belangrijk voor infectie en zo ja, hoe dan?13 Het onderzoek naar de moleculaire pathogenese van mycobacteriële infecties en naar de virulentiefactoren van mycobacteriën is snel uitgegroeid tot een bloeiende onderzoekslijn. Een van de vele hoogtepunten is het ontrafelen van de rol van ESX-5, een complex van eiwitten in de celwand van mycobacteriën dat zorgt voor transport van stoffen over die dikke celwand. Recent is Wilbert’s droom uitgekomen: samen met Edith Houben en met de hulp van promovendi en collega’s uit Duitsland en Oostenrijk heeft hij de structuur van het ESX-5 secretiesysteem in beeld gebracht.14 (Figuur 3) Is het niet prachtig?
Dankzij de voorgenomen Alliantie tussen VUmc en AMC is een nauwe samenwerking tot stand gekomen met Diederik van de Beek, hoogleraar neurologie in het AMC en expert op gebied van hersenvliesontsteking. Wij hebben een Alliantiesubsidie ontvangen om samen onderzoek te doen naar de pathogenese van pneumokokkenmeningitis, de belangrijkste vorm van hersenvliesontsteking in Nederland.
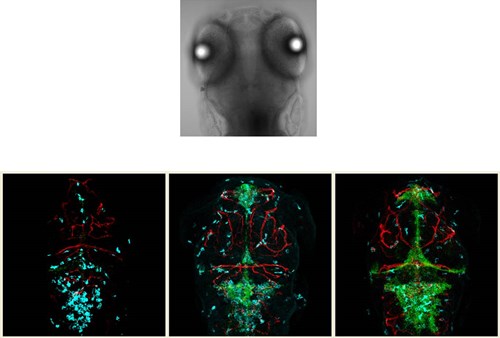
Door pneumokokken fluorescerend te maken, net als de mycobacteriën en in te spuiten bij zebravis embryo’s, hebben we een model om te onderzoeken hoe de pneumokken precies hersenvliesontsteking veroorzaken, om verder te zoeken naar betere vaccins en betere therapieën. Onze promovendus, Kin Ki Jim, heeft dit model uitgewerkt en heeft zich ontpopt als een virtuoze microscopist die met behulp van zebravissen met rood fluorescerende bloedvaten (ja, ook die kan je maken met moleculairbiologische technieken), groen fluorescerende pneumokokken en blauw fluorescerende bloedcellen prachtig laat zien hoe de infectie start en zich uitbreidt (figuur 4).15 U kunt zich voorstellen dat telkens wanneer Kinki met nieuwe beelden en resultaten komt, ik weer het ‘Hey Siri’-gevoel krijg.
IIb - Het verbeteren van de diagnostiek van infectieziekten
Vijftien jaar geleden verscheen een artikel waarvan de titel mijn aandacht trok: klinische microbiologie in het jaar 2025.16 Hierin voorspelden de auteurs dat in 2025 de diagnose van infectieziekten door de dokter aan het bed van de patiënt gesteld zal worden, met behulp van een klein, handzaam apparaatje. Hierin wordt een kleine hoeveelheid materiaal van de patiënt, bijvoorbeeld urine, of sputum of bloed gebracht. In het ene deel van het apparaatje worden DNA en RNA geanalyseerd, in het andere eiwitten, vetten en suikers. Binnen 15 minuten volgt de uitslag: bacterie naam, gevoeligheid voor verschillende antibiotica, veranderingen in RNA en in hoeveelheden eiwitten die duiden op een reactie van het lichaam van de patiënt op een bacteriële of virale infectie.
Zou dit utopie zijn of zou het ooit waar worden, vroeg ik mij toen af. Nu, 15 jaar later, denk ik dat het jaar 2025 voor de diagnostiek van infectieziekten echt dichtbij aan het komen is. Waarom ik dat denk? Omdat de voortekenen gunstig zijn.
Allereerst is er de enorme vlucht die de technieken om DNA en RNA aan te tonen hebben genomen sinds ik als hoogleraar medische microbiologie in VUmc werkzaam ben. Het begon met de polymeraseketting reactie of PCR: in 1995 was men nog zeer sceptisch over het gebruik van de PCR voor diagnostiek omdat er veel problemen waren met contaminatie. Inmiddels hebben we deze problemen onder de knie en nu, zo’n 20 jaar later, behoort de PCR tot de routine diagnostiek en is niet meer weg te denken uit de microbiologische diagnostiek. De PCR is niet alleen snel, maar kan ook micro-organismen aantonen die we eerder niet zagen, omdat ze niet of moeilijk kweekbaar zijn. Vooral voor de diagnostiek van virale infecties heeft dit een ware revolutie met zich meegebracht.
De beroemde Nederlandse voetbalfilosoof parafraserend: elk voordeel heeft zijn nadeel. Moleculaire diagnostiek is snel, maar we krijgen nu regelmatig uitslagen waarvan we niet goed weten wat ze te betekenen hebben. Bijvoorbeeld: bij patiënten met infecties van de luchtwegen vinden we veel vaker dan vroeger verschillende soorten virussen in de keel. Zijn deze virussen de oorzaak van de symptomen, moeten we deze behandelen, of zijn het toevalsbevindingen? We zitten nog in de leerfase: alle nieuwe bevindingen in context plaatsen, zieken en gezonden vergelijken, nagaan of de aanwezigheid van deze virussen gepaard gaat met een afweerreactie van de gastheer. Dit dilemma is veel minder groot bij resultaten van klassieke microbiologische kweken. We gebruiken deze al meer dan 100 jaar en hebben inmiddels geleerd hoe de uitslagen te interpreteren. Niet elke bacterie in de keel hoeft behandeld te worden – we hebben immers een mooie microbiota in onze keel – en ook de aanwezigheid van mogelijk ziekmakende soorten moet beoordeeld worden in het licht van de klachten van de patiënt. Een pneumokok in een keel bijvoorbeeld mag daar rustig blijven zitten als de patiënt geen klachten heeft. Maar elk nadeel heeft ook zijn voordeel: het gemak en de snelheid waarmee moleculaire diagnostiek uitgevoerd wordt maakt dat de leercurve snel kan zijn.
Naast de PCR hebben twee andere moleculaire technieken hun intrede gedaan in de medische laboratoria: de analyse van complexe mengsels van eiwitten en het sequensen van DNA en RNA. Er bestaan inmiddels technieken om duizenden eiwitten in mengsels in kaart te brengen en patronen te herkennen. Een dergelijke techniek wordt gebruikt in de zogeheten MALDI-TOF. Bacteriën bevatten vele eiwitten en elke bacteriesoort heeft een eigen kenmerkend eiwitpatroon. Zo kan men bacteriën met behulp van de MALDI-TOF identificeren. Daar waar je vroeger, als bacteriën eenmaal gegroeid waren op een voedingsbodem, nog minstens 8 en meestal 18-24 uur nodig had om ze op basis van hun biochemische eigenschappen een naam te geven, kan dat nu met de MALDI-TOF binnen enkele minuten. Een groot nadeel van PCR en MALDI-TOF is dat deze technieken geen uitslag geven over gevoeligheid voor antibiotica. Daarvoor hebben we nog steeds de klassieke kweek nodig.
Wat het sequensen van DNA en RNA betreft: in 1995 was dat nog langzaam, duur en het interpreteren van de resultaten allesbehalve eenvoudig. Tegenwoordig kan het sequensen van het gehele genoom van gekweekte bacteriën binnen een aantal uren, maar de interpretatie van de gegevens heeft nog steeds zo veel voeten in de aarde dat sequensen nog geen deel uitmaakt van de routine diagnostiek.
Een volgende stap is om bacterieel DNA direct in patiëntmateriaal op te sporen en te sequensen en bij de uitslag niet alleen bacterienaam, maar ook meteen alle resistentiemechanismen en virulentiefactoren in kaart te hebben. Er is nog een lange weg te gaan, voordat ‘whole genome sequencing’, of WGS, de standaard zal worden in de microbiologische diagnostiek, maar de eerste stappen zijn gezet. In Engeland is men inmiddels bijna klaar om de volledige tuberculosediagnostiek in het hele land om te zetten naar diagnostiek middels WGS.17 In Oxford is een nieuwe techniek ontwikkeld, het zogeheten ‘nanopore sequencing’, om zeer snel en eenvoudig DNA en RNA te sequensen en software om snel de resultaten te analyseren. Het bedrijf uit Oxford heeft inmiddels een klein apparaatje, de MinION, op de markt gebracht waarmee je, waar je ook bent, DNA of RNA kan sequensen en de analyses op je laptop kan uitvoeren (zie figuur 5). De MinION is ook ingezet in West-Afrika, tijdens de Ebola epidemie.18 Je kan hem dus zelfs voor veldwerk gebruiken. Sterker nog, je kan de MinION aan je Smartphone koppelen om de resultaten af te lezen!
De mogelijkheden die de MinION in het verschiet brengt geven mij een heel groot “Hey Siri” gevoel, net als het artikel waarin voorspeld werd dat we in 2025 aan het bed van de patiënt binnen 15 minuten een volledige diagnose zullen stellen en een behandeling starten. 2025? Dat weet ik niet, maar in een toekomst die de huidige artsen-in-opleiding zullen meemaken zeker wel.
Betekent dit het einde van de klassieke microbiologie? Zeker niet! De klassieke microbiologie met microscopie, kweken, herkennen van vormen, kleuren en geuren, biochemische reacties, gevoeligheidsbepalingen en serologische testen blijft de kern, blijft essentieel om alle informatie die we verkrijgen met de moderne technologie te ordenen en te interpreteren. Veranderende of nieuwe ziekteverwekkers en nieuwe vormen van resistentie zullen ons blijven verrassen en zullen leiden tot resultaten die we met moleculaire technieken alléén moeilijk zullen kunnen begrijpen. Daarvoor zullen we kweek, biologische en serologische waarnemingen steeds weer nodig hebben.
III - Toenemende resistentie tegen antibiotica
Daarmee kom ik tot het derde en laatste deel van mijn betoog.
Vorig jaar september werd bij de Verenigde Naties te New York, voor het eerst in haar geschiedenis een General Assembly gehouden over het probleem van resistentie tegen antibiotica. Wat was er aan de hand? Was er iets nieuws gaande dat aandacht behoefde? Nee, antibioticaresistentie is niet nieuw, maar zo oud als de wereld. Micro-organismen maken antibiotica om zich te beschermen tegen andere micro-organismen, dat is een van hun fundamentele eigenschappen. Maar dat brengt met zich mee dat ze tegelijkertijd mechanismen ontwikkelen om zich te beschermen tegen antibiotica die anderen produceren.
Reeds in 1945 waarschuwde Alexander Fleming, de ontdekker van penicilline, dat het niet moeilijk is om bacteriën resistent te maken, als je maar lang genoeg kleine doses geeft. Sindsdien is met grote regelmaat door microbiologen en infectiologen gewaarschuwd dat veelvuldig gebruik van antibiotica leidt tot toenemende resistentie. Zo waarschuwde het wetenschappelijk tijdschrift Science vijfentwintig jaar geleden al voor een postantibiotisch tijdperk en Annals of Internal Medicine voorspelde een wereldwijde calamiteit.19-20 Twintig jaar later werd de alarmklok opnieuw geluid. Verschillende tijdschriften wijdden wéér grote artikelen aan antibioticaresistentie en verschillende rapporten lieten zien dat het probleem wereldwijd nu echt groot aan het worden is.21-23 In ziekenhuizen in Italië, Griekenland, het Midden-Oosten, India en het Verre Oosten, komen veelvuldig bacteriën voor die onbehandelbaar zijn geworden omdat zij resistent zijn tegen alle antibiotica waarover we beschikken.
Het probleem is zo groot geworden door een combinatie van factoren: overmatig en onterecht gebruik van antibiotica bij mensen, in de landbouw en in aquacultuur; lozen van antibiotica in de omgeving bij de productie; onvoldoende infectiepreventiemaatregelen in ziekenhuizen; slechte hygiëne, met name in landen met overbevolking en onvoldoende sanitaire voorzieningen. En tot slot: een groot gebrek aan echt nieuwe antibiotica. Bijna alle antibiotica die we vandaag de dag gebruiken zijn ontdekt tussen 1930 en 1980. De laatste vijfendertig jaar zijn er slechts enkele nieuwe bijgekomen.
Dit heeft twee belangrijke oorzaken.
De eerste is dat gemakkelijk te ontdekken antibiotica inmiddels ontdekt zijn. Nieuwe moleculen en verbindingen vinden vraagt om creatief en tijdrovend onderzoek.
De tweede, wellicht belangrijkste, is dat antibiotica voor de farmaceutische industrie geen interessante medicijnen zijn: de behandeling van een infectie is meestal van korte duur, van enkele dagen tot weken, in ieder geval veel korter dan de behandeling van chronische ziekten zoals diabetes, reuma of hoge bloeddruk. Voor de farmaceutische industrie is een nieuw middel tegen hoge bloeddruk op de markt brengen financieel veel aantrekkelijker dan een nieuw antibioticum.
Hoe komt het dat er nu eindelijk wel algemeen aandacht is voor het probleem van resistentie, in tegenstelling tot 25 jaar geleden? Ten eerste is er het toenemend voorkomen van bacteriën die resistent zijn voor alle antibiotica die we hebben. Dat is schrikken en dat schudt wakker. Ten tweede is ook de publieke opinie wakker geschud, onder andere door de vurige pleidooien van Dame Sally Davies, hematoloog en Chief Medical Officer in het Verenigd Koninkrijk.24 Zij heeft ingezien dat de toenemende antibioticaresistentie onze moderne geneeskunde bedreigt, omdat antibiotica van groot belang zijn bij de bescherming tegen infecties van implantaten, zoals kunstgewrichten of hartkleppen en tijdens behandelingen die de afweer aantasten, denk aan chemotherapie voor kanker.
Het probleem dat ten grondslag ligt aan de toenemende resistentie is een klassiek voorbeeld van wat men in de economie kent als de tragedie van de meent, in het Engels “tragedy of the commons”. Dit houdt in dat individuen handelen in eigen belang en daarbij een gemeenschappelijk goed uitputten. Het begrip ontleent zijn naam aan de Engelse ‘commons’, weiden of meent, waar iedereen zijn koeien vrij mag laten grazen. De individuele boer heeft er baat bij om zoveel mogelijk koeien op die meent te zetten, maar daarmee schaadt hij het algemeen belang, omdat de meent uitgeput raakt. Het begrip ‘tragedy of the commons’ is oud, het werd geïntroduceerd in het economische denken door Hardin in 1968.25 De toepassing op antibiotica is van Baquero en Campos zo’n 15 jaar geleden en past mijns inziens perfect: in het individuele geval is het gebruik van antibiotica maar al te makkelijk, het lijken onschuldige middelen en het ontwikkelen van resistentie zie je niet direct bij je eigen patiënt, maar pas later, bij andere patiënten.26
Dit betekent niet dat je geen antibiotica moet gebruiken, het betekent dat je ze zorgvuldig moet gebruiken, alleen wanneer noodzakelijk, alleen de juiste en niet te lang. Dit geldt bij gebruik voor mensen, maar niet in het minst bij gebruik in de landbouw of aquacultuur.
In Nederland hebben we als bijkomend probleem, dat het probleem hier nog heel klein is en daarom onderschat kan worden. Nederland is één van de landen waar de minste antibiotica bij mensen gebruikt worden. Dit zie je terug in de resistentiecijfers: die behoren tot de laagste ter wereld. Het is van groot belang om dit zo te houden, om te laten zien dat zuinig zijn loont, voor onze toekomst en die van onze kinderen.
Binnen onze afdeling doen we veel onderzoek op dit gebied. Wilbert Bitter werkt met zijn groep, in internationaal samenwerkingsverband, aan het ontwikkelen van nieuwe middelen tegen tuberculose en tegen Gram negatieve bacteriën. Ook doen we onderzoek naar risicofactoren voor het oplopen van resistente stammen. Ascelijn Reuland heeft tijdens haar promotieonderzoek laten zien dat het gebruik van middelen tegen maagzuur de kans op resistente bacteriën verdubbelt. Maagzuurremmers worden in Nederland door minstens twee miljoen mensen gebruikt.27 Reden waarom we nu verder uit zoeken hoe dit precies zit.
Bij de bestrijding van resistentie is het van groot belang om de verspreiding van resistente bacteriën in het ziekenhuis te voorkomen. Naast zorgvuldig antibioticagebruik, is infectiepreventie daarom essentieel. Ik ben dan ook heel blij dat we in VUmc, samen met Michiel van Agtmael, de CIA hebben opgericht: de Commissie Infectiepreventie en Antibioticabeleid. Met de hulp van een I-team en een A-team draagt de CIA er zorg voor dat infectiepreventiemaatregelen goed uitgevoerd worden en antibiotica correct gebruikt worden. Het I-team heeft, onder leiding van Mireille Dekkers en Suzanne van der Werff een mooi netwerk opgericht van Contactpersonen Infectiepreventie, verpleegkundigen die op de verpleegafdelingen onze vooruitgeschoven posten zijn.28 Een belangrijke rol heeft ook promovenda Martine Caris: zij heeft verschillende innovatieve projecten op dit gebied uitgevoerd.29,30 Inmiddels heeft arts-microbioloog Rosa van Mansfeld het team vervoegd. De grote stappen die in VUmc gezet worden op gebied van infectiepreventie en antibioticabeleid zijn voor mij ook een steeds weerkerende bron van ‘Hey Siri’-gevoel.
Wetenschappelijk onderzoek naar de rol van onze microbiota in ziekte en gezondheid, naar moleculaire mechanismen die ten grondslag liggen aan het ziekmakend vermogen van bacteriën, naar hun ongekend vermogen om resistent te worden tegen antibiotica, of naar nieuwe toepassingen om de diagnostiek te verbeteren is prachtig, maar niet alleen om wetenschappelijke nieuwsgierigheid te bevredigen of een ‘Hey Siri’-gevoel op te roepen. Mijn belangrijkste drijfveer voor onderzoek is de kliniek, de patiënt met een infectieziekte die we willen herkennen, begrijpen en behandelen. Zonder goede kliniek, geen goed onderzoek. Daarom ben ik dankbaar dat ik mijn wetenschappelijke carrière heb kunnen inbedden in de afdeling Medische microbiologie en infectiepreventie van VUmc, een afdeling waar de patiënt altijd centraal staat en waar een ongelooflijk kundig en toegewijd team van artsen-microbioloog, medisch-moleculair microbiologen, deskundigen infectiepreventie, aios en analisten zich steeds weer meer dan 100% inzet om te komen tot een juiste diagnose en optimale behandeling.
Mijnheer de rector Magnificus, dames en heren, ik hoop dat het mij gelukt is om u in vogelvlucht te laten zien waarom mijn vak, de medische microbiologie, mij al heel mijn werkzame leven geboeid houdt en maakt dat ik steeds weer zeg: medische microbiologie, het mooiste vak dat er is.