Samenvatting
De influenza-epidemie van het seizoen 2016/2017 begon in week 48 van 2016 en duurde 15 weken. De hoogste incidentie van influenza-achtig ziektebeelden werd gezien tussen week 51 van 2016 en week 5 van 2017.
Influenzavirussen van het H3N2-subtype waren dit seizoen verreweg de belangrijkste veroorzakers van influenza-activiteit. Fylogenetische analyse van dit subtype virussen toonde aan dat de meeste behoorden tot clade 3C.2a1, die echter heterogeen was en bestond uit subgroepen met verschillende aminozuursubstituties die belangrijk waren voor antigeniciteit. Desondanks was de effectiviteit van het vaccin om infectie te voorkomen circa 47 procent. Influenzavirussen van het H1N1pdm09-subtype leverden een geringe bijdrage aan de epidemie, net als influenza B-virussen die voornamelijk behoorden tot de B/Yamagata/16/88-lijn, zoals ook elders in Europa werd waargenomen.
Voor het seizoen 2017/2018 op het noordelijk halfrond heeft de WHO de volgende vaccinsamenstelling aanbevolen:1
- voor A(H1N1)pdm09: een A/Michigan/45/2015-achtig virus;
- voor A(H3N2): een A/Hong Kong/4801/2014-achtig virus;
- voor B: een B/Brisbane/60/2008-achtig virus, van de lijn B/Victoria/2/87.
Van de 990 virussen die zijn getest op gevoeligheid voor neuraminidaseremmers bleek één A(H3N2)-virus een verlaagde gevoeligheid voor zanamivir te hebben en normale gevoeligheid voor oseltamivir en één A(H1N1)pdm09-virus resistent tegen oseltamivir. Alle 62 onderzochte influenza A-virussen bleken resistent te zijn tegen M2-ionkanaalblokkers.
Abstract
The influenza epidemic of the 2016/2017 season in the Netherlands lasted for 15 weeks and was dominated by influenza A viruses of the H3N2 subtype, predominantly of clade 3C.2a1. In addition, influenza B viruses were detected, predominantly of the lineage B/Yamagata/16/88, which displayed antigenic drift compared to viruses that circulated in the previous influenza season. Influenza B viruses of the B/Victoria/2/87-lineage were detected sporadically. Influenza A(H1N1)pdm09 viruses were also sporadically detected that were antigenically indistinguishable from the viruses that have circulated since 2009.
In memoriam
Op 15 april van 2017 bereikte ons het trieste bericht dat Jan de Jong op 81-jarige leeftijd was overleden. Jan heeft zich jaren lang ingezet voor de influenzasurveillance in Nederland, eerst bij het RIVM in Bilthoven en later bij het Erasmus MC in Rotterdam. Met name zijn kritische blik op de antigenetische karakterisering van influenzavirussen met behulp van de hemagglutinatieremmingstest en de interpretatie van de resultaten waren van onschatbare waarde. Als een van de eersten toonde hij aan dat het passeren van influenzavirussen in bebroede kippeneieren antigenetische veranderingen tot gevolg kan hebben.2 Ook speelde hij een cruciale rol bij het vaststellen van de eerste uitbraak van aviaire influenza A/H5N1 in Hong Kong.3 Ondanks dat hij de pensioengerechtigde leeftijd ruimschoots gepasseerd was, bleef Jan met veel passie betrokken bij de surveillancetaken van het Nationaal Influenza Centrum en is hij zich hier belangeloos voor blijven inzetten. Zijn kennis over influenzavirussen was ongeëvenaard en een belangrijke bron van informatie voor de nieuwe generatie influenzaonderzoekers. We blijven ons Jan herinneren als een sociaal bewogen en vriendelijk persoon, die altijd interesse en compassie toonde voor de mensen om hem heen. Zijn aanwezigheid op de afdeling Viroscience van het Erasmus MC wordt buitengewoon gemist.
Influenzavirussen
Influenzavirussen worden onderverdeeld in de typen A, B, C en D. Binnen type A worden subtypen onderscheiden, waarvan thans A(H3N2) en A(H1N1)pdm09 bij de mens voorkomen.4 Binnen type B worden twee fylogenetische lijnen onderscheiden, de B/Victoria/2/87-lijn en de B/Yamagata/16/88-lijn, die ook antigenetisch verschillen.5 Alle humane influenza A- en B-virussen ondergaan regelmatig kleine antigene veranderingen (‘antigene drift’) die historisch gezien worden bepaald met de hemagglutinatieremmingstest (HAR).4,6 Het in Nederland gebruikte influenzavaccin is trivalent en bevat geïnactiveerd virus van beide A-subtypen en een van de twee B-lijnen en wordt jaarlijks door de WHO aangepast aan de antigene veranderingen die bij de epidemische virussen worden waargenomen.
Influenzasurveillance
De influenzasurveillance wordt in Nederland al jaren op een vergelijkbare manier uitgevoerd door een aantal instituten en instanties.7
Elk jaar wordt tijdens het griepseizoen de klinische influenza-activiteit gekwantificeerd door het aantal patiënten te registreren dat zich met een influenza-achtig ziektebeeld (IAZ) wekelijks bij de huisarts meldt. Tevens wordt het aantal patiënten met een acute respiratoire infectie anders dan IAZ geregistreerd. Daarnaast worden virussen die worden gedetecteerd in respiratoire monsters van huisarts- en ziekenhuispatiënten genetisch en antigenetisch gekarakteriseerd en wordt hun gevoeligheid voor antivirale middelen vastgesteld.
De Nederlandse bevindingen worden wekelijks gerapporteerd aan het European Centre for Disease Prevention and Control (ECDC) en de WHO. Tevens wordt een selectie van de Nederlandse virusisolaten naar het WHO Collaborating Centre in Londen gestuurd voor aanvullend vergelijkend onderzoek.
Resultaten en discussie
De influenza-epidemie van het seizoen 2016/2017
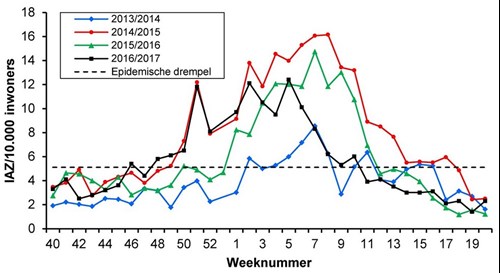
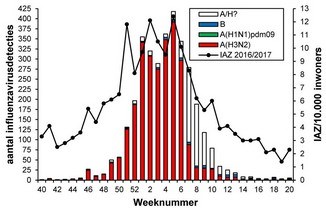
Gegevens van NIVEL Zorgregistraties eerste lijn lieten zien dat de influenza-epidemie van het seizoen 2016/2017 in week 48 van 2016 de epidemische drempel van 5,1 patiënten met IAZ per 10.000 inwoners (zie figuur 1) overschreed. Met 15 weken was, net als het seizoen 2014/2015, sprake van een influenza-epidemie die langer duurde dan het gemiddelde van negen weken in de afgelopen 20 jaar. De hoogste incidentie van influenza-achtig ziektebeelden werd gezien tussen week 51 van 2016 en week 5 van 2017.8
Overzicht van de onderzochte influenzavirussen
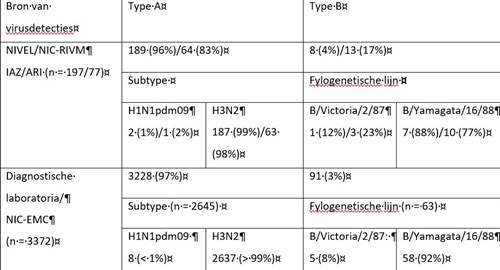
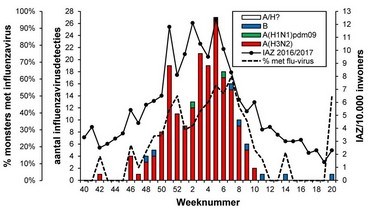
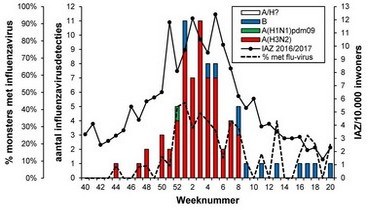
Van alle in het seizoen 2016/2017 onderzochte influenzavirussen met monsterafnamedatum in week 40/2016 tot en met week 20/2017 waargenomen bij patiënten met IAZ of ARI door NIVEL/RIVM (respectievelijk n = 197 en n = 77) en door het Erasmus MC van diagnostische laboratoria ontvangen virussen (n = 3372) (zie tabel 1, figuren 2A en B en figuur 3), bleken verreweg de meeste van het type A te zijn (respectievelijk 96 en 98 procent). Daarvan was de overgrote meerderheid van het H3N2-subtype en werden slechts sporadisch virussen van het H1N1pdm09-subtype waargenomen. Van de influenza B-virussen, die dus een klein aandeel hadden in de epidemie van dit seizoen, bleken de meeste van de B/Yamagata/16/88-lijn te zijn. Overigens was deze lijn niet vertegenwoordigd in het trivalente vaccin dat in Nederland wordt gebruikt. Slechts sporadisch werden influenza B-virussen van de B/Victoria/2/87-lijn waargenomen.
Karakterisering van influenza A(H1N1)pdm09-virussen
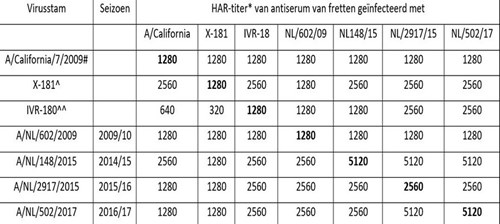
A(H1N1)pdm09-virussen veroorzaakten de pandemie van 2009 en hebben na hun introductie in de humane bevolking nog geen significante antigene drift laten zien. Het vaccin heeft derhalve goede bescherming geboden tegen de epidemische A(H1N1)pdm09-virussen (zie tabel 2). Desondanks heeft de WHO besloten om voor het seizoen 2017/2018 de huidige vaccinstam A/California/7/2009 te vervangen door een andere omdat met sera van gevaccineerde individuen tegen sommige recent gedetecteerde virussen een slechte reactiviteit werd waargenomen. Met deze beslissing hoopt men het optreden van antigene drift binnen dit subtype volgend jaar voor te zijn.
Fylogenetische analyse lokaliseerde alle vier onderzochte A(H1N1)pdm09-influenzavirussen in clade 6B.1.
Karakterisering van influenza A(H3N2)-virussen
Al enige jaren blijkt de antigenetische karakterisering van A(H3N2)-virussen problematisch. Veel van de recent geïsoleerde influenza A(H3N2)-virussen vertonen geen enkele hemagglutinatie (HA)-activiteit. Van sommige virussen die nog wel hemagglutinatie vertonen, bleek deze gevoelig voor het toedienen van de neuraminidaseremmer oseltamivir, wat betekent dat het neuraminidase en niet hemagglutinine verantwoordelijk was voor de HA-activiteit. 9-11
Slechts een zeer klein aantal virussen laat nog HA-activiteit zien in de aanwezigheid van oseltamivir. Daarom is voor de antigenetische karakterisering van A(H3N2)-virussen vaak aanvullend onderzoek nodig met behulp van alternatieve serologische assays die niet afhankelijk zijn van hemagglutinerend vermogen van deze virussen, zoals virusneutralisatie-(VN) assays. Ook wij hebben een dergelijke assay ontwikkeld12 en gebruikt voor de karakterisering van A(H3N2)-virussen van dit seizoen.
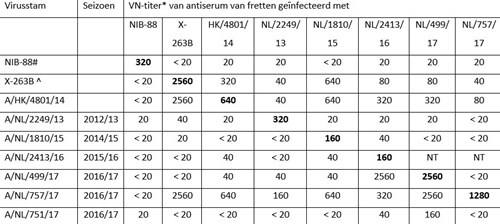
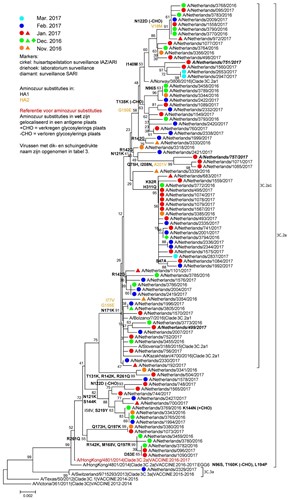
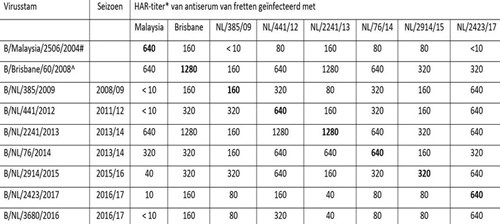
Zoals uit tabel 3 blijkt laten virussen geïsoleerd in het seizoen 2016/2017 een heterogene reactiviteit zien met sera opgewekt tegen de vaccinstam en representatieve epidemische stammen. Influenzavirus A/NL/757/17 lijkt antigenetisch overeen te komen met de gebuikte vaccinstam X-263B, die is gebaseerd op de referentiestam A/Hong Kong/4801/2014. Daar staat tegenover dat het antiserum opgewekt tegen de vaccinstam vrijwel geen reactiviteit laat zien tegen de epidemische stammen A/NL/499/2017 en A/NL/751/2017. Deze drie virussen verschillen in aminozuurvolgorde op posities die belangrijk zijn voor antigeniciteit en die de verschillen in VN-titers mogelijk kunnen verklaren (zie figuur 4). Het vaccin zal dus tegen sommige groepen A(H3N2)-virussen wel goede bescherming hebben geboden en tegen andere niet.
Omdat volgens de WHO de meeste virussen antigenetisch toch lijken op de gebruikte vaccinstam voor dit subtype en het niet gemakkelijk blijkt om een nieuwe representatieve stam te kiezen die de heterogeniteit van virussen binnen dit subtype dekt, is besloten om de huidige vaccinstam voor het volgend seizoen te handhaven. Ook nucleotidesequentie-analyse liet een hoge mate van heterogeniteit zien binnen de A(H3N2)-virussen van het afgelopen seizoen.
Op het NIC werden 98 willekeurig geselecteerde A(H3N2)-virussen fylogenetisch geanalyseerd. Hiervan behoorden er 97 tot clade 3C.2a en 79 tot clade 3C.2a1 (zie figuur 4). De virussen binnen deze clades waren heterogeen en konden worden verdeeld in verschillende subgroepen met aminozuursubstituties op posities van het hemagglutinine die belangrijk zijn voor de antigeniciteit ten opzichte van de vaccinstam (zie figuur 4). Ook elders in Europa werden voornamelijk virussen uit clades 3C.2a en 3C.2a1 gevonden. Zoals boven aangegeven adviseerde de WHO in februari van 2017 de huidige A(H3N2)-vaccinreferentiestam A/Hong Kong/4801/2014 opnieuw te gebruiken voor het komende seizoen.1
Karakterisering van influenza B-virussen van de B/Victoria/2/87-lijn
Virussen van de influenza B/Victoria/2/87-lijn werden in het seizoen 2016/2017 slechts sporadisch waargenomen en vertonen antigene drift sinds 2012. Antisera tegen oudere epidemische stammen zoals B/NL/441/2012, B/NL/2241/2013, B/NL/76/2014 en B/NL/2914/2015 gaven titers tegen virussen uit 2016/2017 die een factor 4 of meer lager waren dan de corresponderende homologe titers (zie). Fylogenetische analyse liet zien dat alle drie onderzochte B/Victoria/2/87-lijn virussen behoorden tot clade 1A.
Karakterisering van influenza B-virussen van de B/Yamagata/16/88-lijn
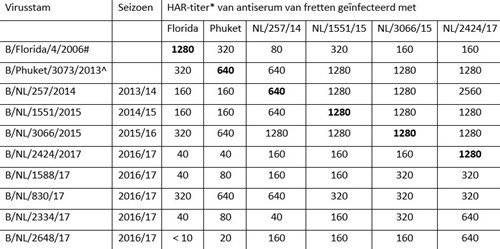
De meeste influenza B-virussen die dit seizoen werden waargenomen waren van de B/Yamagata/16/88-lijn, die niet vertegenwoordigd was in het vaccin. Daarom zal het vaccin tegen deze influenza B-virussen slechte bescherming hebben geboden.
Ook binnen deze lijn van influenza B-virussen is sinds het seizoen 2015/2016 antigene drift opgetreden. Zoals uit tabel 5 blijkt gaven antisera opgewekt tegen de oude epidemische stammen B/NL/257/2014, B/NL/1551/2015 en B/NL/3066/15, respectievelijk uit de seizoenen 2013/2015, 2014/2015 en 2015/2016 beduidend lagere titers tegen de meeste in Nederland in 2016/2017 verkregen virusisolaten, dan de corresponderende homologe titers (zie tabel 5). Ook het antiserum opgewekt tegen de oude vaccinstam van de B/Yamagata/16/88-lijn, B/Phuket/3073/2013, liet een slechte reactiviteit zien met de meeste B/Yamagata/16/88-virussen van dit seizoen.
Fylogenetische analyse liet zien dat alle 15 onderzochte B/Yamagata/16/88-lijnvirussen van 2016/2017 behoorden tot clade 3, waarin zich ook de oude vaccinstam B/Phuket/3073/2013 bevindt.
Een geval van varkensinfluenza bij een kind
In oktober van 2016 is in Nederland bij een kind een ernstige acute luchtweginfectie met een varkensinfluenzavirus vastgesteld. Het betrof een infectie met een varkens A(H1N1)- influenzavirus van de zogenoemde Euro-Aziatische vogellijn. Het kind had een varkensstal bezocht en een vergelijkbaar virus werd bij varkens aangetroffen. De patiënt is na intensieve behandeling volledig hersteld en verspreiding van het virus kon niet worden aangetoond.13 Zoönotische infecties met varkensvirussen die tot ernstige ziekte leiden zijn zeldzaam en worden daarom sporadisch gediagnostiseerd.
Vaccineffectiviteit
Preliminaire schattingen van de vaccineffectiviteit in Canada en Europa lieten zien dat de overall effectiviteit van het vaccin tegen influenza A(H3N2)-virussen ongeveer 40 procent bedroeg.14,15 Het circuleren van veel antigenetisch verschillende virussen van dit subtype heeft waarschijnlijk bijgedragen aan suboptimale vaccineffectiviteit. Hoewel suboptimaal, was de vaccineffectiviteit wel veel beter dan in het ook door A(H3N2)-virussen gedomineerde seizoen 2014/2015, toen de vaccinstam van de 3C.3a clade maar weinig bescherming bood tegen de circulerende virussen van de 3C.3a clade. Ook in Nederland werd vaccineffectiviteit gemeten en vergeleken met die gezien in andere landen van Europa. In Nederland werd de vaccineffectiviteit als geheel geschat op 47 procent.15 Met name bij ouderen boven de 60 jaar werd een hogere vaccineffectiviteit gezien dan elders in Europa. Een goede verklaring hiervoor ontbreekt, maar mogelijk hebben regionale verschillen in de circulatie van antigenetisch verschillende virussen een rol gespeeld.
Vaccinsamenstelling voor het seizoen 2017/2018
In februari 2017 adviseerde de WHO voor het influenzavaccin voor het seizoen 2016/2017 op het noordelijk halfrond de volgende samenstelling.12
- A/Michigan/45/2015 (H1N1)pdm09-achtig virus;
- A/Hong Kong/4801/2014 (H3N2)-achtig virus – een clade 3C.2a virus;
- B/Brisbane/60/2008-achtig virus – een virus van de B/Victoria/2/87-lijn.
Gevoeligheid voor antivirale middelen
Uit het seizoen 2016/2017 werden 990 influenzavirussen – 12 A(H1N1)pdm09, 964 A(H3N2) en 14 type B – onderzocht op gevoeligheid voor antivirale middelen. Eén A(H3N2)-virus had fenotypisch een verlaagde gevoeligheid voor zanamivir en normale gevoeligheid voor oseltamivir. Er werden echter geen aminozuursubstituties gevonden die dit kunnen verklaren. Eén A(H1N1)pdm09-virus (uit twee sequentiële monsters van een met oseltamivir behandelde patiënt) was resistent tegen oseltamivir met een H275Y-aminozuursubstitutie in het neuraminidase. Voor de overige geteste influenza A- en B-virussen werden geen aanwijzingen gevonden voor resistentie tegen de neuraminidaseremmers. Alle 62 geteste influenza A-virussen bleken resistent te zijn tegen M2-ionkanaalblokkers.
Conclusie
De influenza-epidemie van het seizoen 2016/2017 duurde 15 weken en werd gedomineerd door A(H3N2)-virussen van vooral clade 3C.2a1. Daarnaast werden ook influenza B-virussen van met name de fylogenetische lijn B/Yamagata/11/86 waargenomen, die ten opzichte van het vorige influenzaseizoen antigene drift lieten zien. Virussen van de B/Victoria/2/87-lijn werden sporadisch aangetroffen. Sporadisch werden ook influenza A(H1N1)pdm09-virussen aangetroffen, die antigenetisch niet te onderscheiden waren van de virussen die sinds 2009 hebben gecirculeerd.
Dankbetuigingen
Ook in het seizoen 2016/2017 waren de bijdragen van de peilstationhuisartsen van NIVEL Zorgregistraties eerste lijn (registratie van gevallen van IAZ en verzending van klinische monsters naar het NIC-RIVM) essentieel voor de influenzasurveillance in Nederland. Zonder de bereidwilligheid van de hoofden van de diagnostische laboratoria om influenzaviruspreparaten naar het Erasmus MC te sturen, was deze surveillance evenmin mogelijk geweest.
The authors gratefully acknowledge the generous gift of influenza reference viruses and antisera from Dr. J. McCauley from the World Influenza Centre in London.
De auteurs danken R. van Beek, M. Pronk, M. Silva (het NIC-Erasmus MC), M. Bagheri, T. Marzec, G. Goderski, S. van den Brink, A-M. van den Brandt, P. Overduin en A. Teirlinck (het NIC-RIVM) en E. Wentink, M. Heshusius-van Valen en J. Gravestein (NIVEL) voor de uitstekende technische ondersteuning.