Keynote lectures
Zoonoses and antimicrobial resistance: collaboration between meds and vets
J.A. Wagenaar, E. Broens, D. Speksnijder
Department of Infectious Diseases and Immunology, Faculty of Veterinary Medicine, Utrecht University, The Netherlands; Wageningen Bioveterinary Research, Lelystad, The Netherlands; WHO-Collaborating Center for Campylobacter and OIE Reference Laboratory for Campylobacteriosis.
In countries with humans and animals living closely together in high densities, there is a continuous threat of transmission of zoonotic pathogens and antimicrobial resistant (AMR) organisms between animals and humans. This is not restricted to occupational exposed people but also a risk for the general population. In The Netherlands, the emergence of resistant bacteria in livestock and their transmission to humans (e.g. Livestock Associated-MRSA, ESBL producing E. coli), and the largest Q-fever outbreak in humans ever reported with its origin in goat farms, led to a growing concern about possible human health implications of livestock production. As a consequence of these events, the collaboration between public health (medical doctors) and veterinarians intensified with mutual respect for their responsibilities. To protect public health, the animal sectors (farmers and veterinarians) managed to achieve an almost 70% reduction in antimicrobial use (AMU) in farm animals over the last 9 years. The use of antimicrobials defined as ‘’critically important for human health’’ (fluoroquinolones and 3rd and 4th generation cephalosporins) in livestock reduced to almost zero. Parallel to reduction of AMU there was a reduction of AMR in livestock observed as reported in the combined NethMap-MARAN report - another example of integration between medical and veterinary infectious diseases domains. In this lecture several case studies will highlight the power of the collaboration.
MALDI-TOF MS determination of fungi
M. Hendrickx
Mycology and Aerobiology, BCCM/IHEM collection, Scientific Institute of Public Health, Brussels, Belgium
The diagnosis of invasive fungal disease remains challenging in the clinical laboratory. The use of MALDI-TOF MS for the identification of micro-organisms has successfully been introduced in clinical laboratories, but its use for the identification of filamentous fungi remains less widely introduced.
Most studies report very high accuracy though for the identification of filamentous fungi by MALDI-TOF MS. Its cost effectiveness, short analysis time, low error rate and the fact that it can also discriminate between closely related and cryptic species, makes it appropriate for implementation in the clinical routine. Two drawbacks remain the availability of extended reference spectra databases and the fact that this technique can only be applied on isolates.
At the BCCM/IHEM collection, an extensive database of reference spectra, covering all medically relevant fungal species has been developed and validated for its use on clinical isolates. Its use on several fungal groups such as dermatophytes or members of the genus Fusarium, or of the Aspergillus niger group has been evaluated. Moreover, the identification of fungal strains using this in house created database has been implemented in the quality control of the BCCM/IHEM collection (ISO 17025 accredited). More recently, an online identification tool has been presented that allows researchers or medical practitioners to upload their MALDI-TOF MS spectrum and to obtain the identification of their strain.
In conclusion, MALDI-TOF MS is a rapid, robust and powerful tool for the identification of micro-organisms, including filamentous fungi.
The availability of an extensive and reliable database is indispensable.
Culture-independent targeted next generation sequencing of the 16S-23S rRNA region for the identification of bacterial species directly from clinical samples: opportunities and challenges
A.M.D. Kooistra-Smid,1,2 E. van Zanten1, G.J. Wisselink1, A.J. Sabat2, V. Akkerboom2, A. Ott1, W.H.M. Vogels1, G.D. Mithoe1, R.F. de Boer1, A.W. Friedrich2, J.W.A. Rossen2
1Department of Medical Microbiology, Certe, Groningen, The Netherlands, 2Department of Medical Microbiology, University of Groningen, University Medical Center Groningen, Groningen, The Netherlands
Accurate and rapid species identification is essential for successful treatment and clinical management of bacterial infections. Detection and identification of bacterial species highly depends on culture. The role of molecular tests is still growing. However, both culture and molecular methods have serious limitations; culture yield may be hampered in case of slow-growing and fastidious bacteria. PCR-based methods are rapid and sensitive, but need an a priori knowledge of the likely pathogenic species that might be present in clinical samples. Furthermore, differentiation of multiple bacterial species in clinical samples is almost not feasible with Sanger sequencing. Previously, we developed an easy-to use, culture-independent method, based on Next Generation Sequencing (NGS) of PCR amplicons encompassing the entire 16S-23S rRNA region, to improve bacterial species identification (Sabat et al. Sci Rep. 2017). Here, new opportunities and challenges of 16S-23S rDNA NGS will be discussed. Furthermore, the results of 16S-23S rDNA NGS analysis applied directly on clinical samples as part of a validation study will be presented.
NGS of the 16S-23S rRNA region has the potential to increase the diagnostic yield of bacteria involved in complex infections. It also enables detection of unanticipated bacterial pathogens. However, this approach needs further validation. Furthermore, studies that focus on clinical relevance are necessary to determine the applicability of this NGS-based approach in routine diagnostics. Finally, multidisciplinary teams are needed to share their knowledge, in order to translate the results of this new test in a report that meets the needs of treating physicians.
Tick-borne relapsing fever Borrelia: right in our backyard?
A. Wagemakers1,2, J. Koetsveld2, H. Sprong3, J.W. Hovius2
1Department of Medical Microbiology and Infection Prevention, VUmc, Amsterdam, 2Center for Experimental and Molecular Medicine, AMC, Amsterdam, 3Center for Infectious Disease Control, RIVM, Bilthoven
The genus Borrelia can be divided into Lyme Borrelia species (Borrelia burgdorferi sensu lato, s.l.) and relapsing fever Borrelia species. Most relapsing fever species are found in soft ticks, with the highest disease burden in Senegal (B. crocidurae) and Tanzania (B. duttonii). These spirochetes cause fever with a relapsing pattern due to their ability to switch serotypes, enabling minority serotypes to evade the host antibody response. One relapsing fever Borrelia species, Borrelia miyamotoi, is found in hard (Ixodes) ticks, which are the vector of B. burgdorferi s.l. and many other human pathogens. Indeed, we identified B. miyamotoi in 2.5% of Dutch Ixodes ticks. Interestingly, B. miyamotoi and B. burgdorferi s.l. were found in the same ticks more often than expected, suggesting similar reservoir hosts. Indeed, we found 9% of wild rodents and 8% of birds in The Netherlands to be infected with B. miyamotoi. Furthermore, in an immunocompromised patient from Zandvoort with a meningo-encephalitis we detected B. miyamotoi in the CSF by PCR, marking the first European B. miyamotoi patient. Next, we developed a culture method for B. miyamotoi, which enabled us to study B. miyamotoi pathogenesis. Similar to other tick-borne relapsing fever (TBRF) spirochetes, and in contrast to B. burgdorferi s.l., B. miyamotoi is predominantly present in the blood compartment. Like other TBRF species, it also evades host antibody responses due to the emergence of minority serotypes with different var iable major proteins (Vmps). Using these Vmp antigens we were able to detect antibody responses in PCR-confirmed B. miyamotoi-infected patients.
Tick-borne encephalitis
S. Van Den Broucke, U. Maniewski, E. Bottieau, M. Van Esbroeck
Department of Clinical Sciences, Institute of Tropical Medicine, Antwerp, Belgium
In Belgium, only few cases of Tick-borne encephalitis (TBE) are diagnosed annually, all in patients acquiring infection abroad. TBE is caused by 3 closely related flaviviruses and it involves the central nervous system. The tick-borne encephalitis virus infects a range of hosts including ruminants, birds, rodents, carnivores, horses, and humans. In Europe and Asia between 10000 and 15000 TBE cases are reported annually. This number very likely underestimates the real incidence. TBE is transmitted to humans by the bite of a tick (either Ixodes persulcatus or Ixodes ricinus) and occasionally following consumption of infected unpasteurized milk. The ratio of asymptomatic infections is between 70% and 98%. The initial phase of disease correlates with viremia and with non-specific flulike symptoms. The second phase manifests as meningitis, encephalitis, or meningoencephalitis. The long-term prognosis is unfavorable in about 40% to 50% of patients who sustain sequelae for months to years. As a rule, anti-TBEV- IgM and usually TBEV-IgG antibodies are present in the first serum samples taken when CNS symptoms manifest in the second phase of the disease. In the first phase of illness, the virus can be isolated or detected by RT-PCR from blood, but only rarely is TBEV detected at the beginning of the second phase in CSF and occasionally in cases of progressive disease. There is no specific antiviral treatment for TBE and supportive care is the mainstay of treatment. Personal protective measures help in prevention of tick bites. In Europe two vaccines are licensed: FSME immun® and Encepur®.
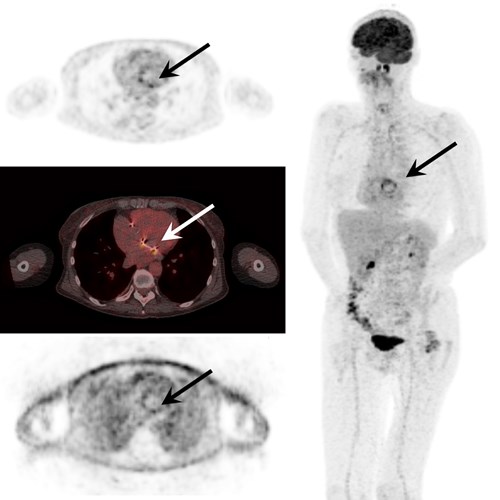
Chronic Q fever
C.P. Bleeker-Rovers
Department of Internal Medicine, Radboud University Medical Center, Nijmegen
Q fever is a zoonosis caused by the intracellular Gram-negative coccobacillus Coxiella burnetii. Following primary infection, 1-5% of all patients develop chronic Q fever with endocarditis, infected aneurysms or infected vascular prostheses as most important manifestations. The duration between primary infection and manifestation of chronic infection may be several years. Several risk factors for the development of chronic infection have been identified and include valvulopathy or prior valve surgery, aneurysm, vascular prostheses, renal insufficiency, older age, immunocompromised state and malignancy. Diagnosing chronic Q fever is difficult as patients often present with nonspecific symptoms. A final diagnosis relies on a combination of clinical signs, serology, PCR on blood or tissue and radiological findings. Patients are classified as proven, probable or possible chronic Q fever patients according to the Dutch chronic Q fever consensus group guideline. Between 2007 and 2010, there was a large Q fever outbreak in The Netherlands. It is estimated that over 40,000 people were infected with major impact on physical and psychological health. Following this outbreak, all known chronic Q fever patients were included in an ongoing nationwide registration (219 patients with proven chronic Q fever and 74 with probable chronic Q fever). Q fever related mortality was 25% in patients with proven chronic Q fever and 4% in probable chronic Q fever. Complications were associated with chronic Q fever-related mortality. Based on results from this national database new insights in diagnosis, complications, and treatment will be discussed.
Parallel sessions
Impact of agar reading frequency on the reporting of blood culture results
B. van den Poel, S. Desmet, J. Verhaegen
Department of Laboratory Medicine, UZ Leuven, Leuven
Rapid identification and antimicrobial susceptibility (AMS) result of bacteria causing blood stream infections is crucial in the management of septic patients. In this study, we compared a period of twice-daily and a period of thrice-daily reading of subculture agar plates. In 2016, 10 644 positive blood cultures bottles (bioMérieux) from 2608 patients were analyzed at UZ Leuven. Identification and antimicrobial susceptibility testing were performed by MALDI-TOF MS (Bruker Daltonics) and Vitek® 2 (bioMérieux) respectively. In period 1 (January to June), subculture plates were read at 8.30 am and 2 pm during the weekdays. In period 2 (August until December), reading was performed at 8.30 am, 2 pm and 5 pm. Time to identification and time to AMS result after positivity were compared. In period 1, median time to identification of all organisms was 22.8 hours compared to 20.2 hours in period 2 (p < 0.0001, Wilcoxon-Mann-Whitney U test). Moreover, micro-organisms were identified before 12 hours in 9% (418/4559) of samples in period 2, a significant increase compared to 1.7% (88/5035) in period 1 (p < 0.0001, Fisher-Exact). In period 2, AMS result was known within 36 hours in 39% (431/1107) of samples, compared to 31% (409/1337) in period 1 (p < 0.0001, Fisher-Exact). Optimization of the reading frequency of subcultures of blood cultures significantly decreases time to results. Further optimization can be done by introducing lab automation. We will use the data of this study as baseline to analyze the impact of introducing WASPLab (Copan Diagnostics) automation on time to result.
Genomic resolution of methicillin-sensitive Staphylococcus aureus outbreaks in a neonatal intensive care unit
A.J.H. Cremers1, J.P.M. Coolen1, C.P. Bleeker-Rovers2, D. Haverkate1, A.D.J. van der Geest3, A. van Heijst4, H. Hendriks4, S.S.V. Henriet5, M.A. Huynen6, E. Kolwijck1, D. Liem4, W.J.G. Melchers1, A. van Summeren3, J. Zoll1, J. Hopman1*, H.F.L. Wertheim1*
1Department of Medical Microbiology, Radboudumc, Nijmegen, The Netherlands, 2Department of Internal Medicine, Radboudumc, Nijmegen, The Netherlands, 3Occupational Health & Safety and Environmental Service, Radboudumc, Nijmegen, The Netherlands, 4Department of Neonatology, Radboudumc, Nijmegen, The Netherlands, 5Department of Pediatrics, Radboudumc Amalia Children’s Hospital, Nijmegen, The Netherlands, 6Centre for Molecular and Biomolecular Informatics, Radboud Institute for Molecular Life Sciences, Radboudumc, Nijmegen, The Netherlands, *J. Hopman and H.F.L. Wertheim share senior authorship
Accurate reconstruction of outbreaks can direct infection control measures. We examined whether whole genome sequencing (WGS) analyses improved outbreak tracing in a neonatal intensive care unit (NICU) in comparison with Multiple-Locus Variable number tandem repeat Analysis (MLVA) typing.
During 2014 and 2015 all methicillin-sensitive Staphylococcus aureus (MSSA) isolates from weekly throat surveillance cultures at a third level Dutch NICU were typed by spa and MLVA. On two occasions, when invasive MSSA infections seemed to originate from carriage outbreaks, all health care workers (HCWs) were tested for MSSA carriage. Those HCWs who carried outbreak MLVA types were decolonized. WGS of isolates that corresponded to the outbreak spa types was followed by a series of automated tools including de novo assembly, identifying and localizing high quality single nucleotide polymorphisms (SNPs), and in depth analysis of outbreak clusters.
MSSA was isolated in 19% (214/1154) of surveillance cultures, and in 24% of HCWs. WGS analysis identified isolates that were, based on MLVA typing, unjustly clustered. Furthermore, detailing particular clusters improved transmission chain resolution, and knowledge of the distribution of SNPs across the genome improved accuracy of the estimated relatedness of strains. WGS analysis provided evidence for HCWs being involved in both outbreak transmission chains. Contrary to what was concluded from classical typing methods, a HCW involved in the first outbreak had re-acquired a nearly identical MSSA strain, which was however unrelated to the second outbreak.
WGS analysis improved the reconstruction of MSSA outbreaks, with important implications for HCWs involved.
Can infection prevention measures for Clostridium difficile be tailored to specific strain types?
R. van Houdt1, A. Zomer2, J. van Prehn1, R. van Mansfeld1, C.M.J.E. Vandenbroucke-Grauls1
1Medical Microbiology and Infection Control, VU University Medical Center, Amsterdam, The Netherlands; 2Department of Infectious Diseases and Immunology, Utrecht University, Utrecht, The Netherlands
During a C. difficile outbreak in the VUmc in 2013-2014, 86 patients were infected with the B1/NAP1/027 strain. Besides transmission of this 027 outbreak strain, there were also C. difficile infections with other ribotype strains. In order to assess whether infections with other ribotypes were nosocomial or not, whole genome sequencing was performed on a random selection of the second most prevalent ribotype, 014.
After sequencing isolates from 15 randomly selected inpatients from 2014, single nucleotide polymorphism (SNP) analysis was used to determine the phylogenetic relationship and compared with the SNP analysis of the ribotype 027 strains from the outbreak.
In 2014, 101 patients had a C. difficile infection of which 25 were caused by the ribotype 014 strain. Core genome SNP analysis of 16 ribotype 027 strains showed a maximum of 2 SNPs difference. SNP analysis of 15 ribotype 014 strains resulted in 4 distinct clusters, 3 clusters consisting of 2 strains and 1 cluster consisting of 3 strains, with a maximum of 10 and 26 SNPs difference, respectively. The other 6 strains were unrelated.
SNP analysis suggested that the ribotype 014 strains were unrelated strains or small clusters, indicating no or little risk on nosocomial transmission, as opposed to the proven transmission of the B1/NAP1/027 strain. We suggest that stringent infection control measures are required to prevent large outbreaks of ribotype 027 strains, while we feel that less stringent measures may be sufficient to prevent outbreaks with C. difficile other that ribotype 027.
Detection and discrimination of ten clinically relevant Candida spp. with a novel real time molecular assay
C.F.M. van der Donk1, L. Roorda2, B. Kraak2, A. Burggraaf2, D. Willems3, M.H.A. Hermans3, F. Hagen4, A. van der Zee2
1Erasmus Medical Centre, Department of Medical Microbiology and Infectious Diseases, Rotterdam, 2Maasstad Hospital, Molecular Diagnostics Unit, Rotterdam, 3Jeroen Bosch Hospital, Department of Medical Microbiology, ’s-Hertogenbosch, 4Canisius Wilhelmina Hospital, Department of Medical Microbiology, Nijmegen, The Netherlands
In current Candida diagnostics often cultivation on selective media is used to identify Candida species. MALDI-TOF analysis of Candida species improved correct identification and shortened time for a final diagnosis but a test that discriminates correctly between closely related species like C. albicans and C. dubliniensis and the C. parapsilosis species complex is not available. Here we describe a fast and accurate real-time PCR assay for detection and identification of 10 medically relevant Candida spp.
Primers and probes were designed to specifically amplify DNA of Candida albicans, C. glabrata, C. dubliniensis, C. tropicalis, C. lusitaniae, C. parapsilosis, C. metapsilosis, C. orthopsilosis, C. guilliermondii and C. krusei. DNA was extracted with MagNA Pure 96 and real-time PCR was performed with Biorad CFX96 thermocycler. The real-time PCRs were optimized and showed good results with regard to efficiency, sensitivity and reproducibility, and specificity.
Various clinical materials were tested for the presence of Candida spp. Routine diagnostic samples that were culture positive correlated well with respect to Cq values and growth quantification. We also demonstrated low levels of Candida spp. DNA in several materials, which is discussed.
This paper describes a validated and robust real-time PCR assay with high sensitivity, 100% specificity, and reproducibility for the detection and differentiation of ten important Candida spp. This assay can be used as a single or multiplex assay without loss of sensitivity and can be adopted to medically required preferences.
Evaluation of UMIC microdilution strip for colistin and piperacillin-tazobactam in non-cystic and cystic fibrosis patients
A. Muyldermans, S. Paternoster, M. Tajdar, E. Nulens
Laboratory Medicine, Medical Microbiology, Algemeen Ziekenhuis Sint-Jan Brugge-Oostende AV, Bruges, Belgium
Antimicrobial susceptibility testing (AST) for colistin (COL) and piperacillin-tazobactam (PTZ) is challenging. Disk and agar gradient diffusion methods are not accepted by EUCAST, broth microdilution (BMD) is the method of choice. In cystic fibrosis (CF) patients AST is further complicated by the fastidious growth of mucous bacteria. We evaluated the BMD method UMIC (Biocentric) on isolates of non-CF and CF patients.
22 isolates from non-CF patients [P. aeruginosa (n = 7), B. cepacia (n = 1), Enterobacteriaceae (n = 14)], 17 isolates from CF patients [P. aeruginosa (n = 10), A. xyloxidans (n = 7)] and 9 QC strains from UK Neqas [P. aeruginosa (n = 7), Enterobacteriaceae (n = 2)] were included. AST of COL and PTZ with UMIC was compared with our routine method: semi-automated testing by Phoenix in non-CF, disk diffusion in CF and reference laboratory for QC strains.
In non-CF patients a categorical agreement (CA) of 100% for COL and 86% for PTZ (2 minor errors, 1 very major error) was found. In CF patients a CA of 88% for COL (2 minor errors) and 100% for PTZ was found, if UMIC was incubated in CO2 for 48h. In QC strains a CA of 78% for COL (2 very major errors) and 86% for PTZ (1 very major error) was found (P. aeruginosa isolates with low-level resistance).
A good categorical agreement for COL and PTZ was found in non-CF and CF patients. In CF patients prolonged incubation in CO2 is necessary. Further evaluation is needed to determine essential agreement (no reliable MIC was given with the routine semi-automated AST).
Evaluation of the Accelerate Pheno System for rapid antimicrobial susceptibility testing in extended-spectrum β-lactamase producing Enterobacteriaceae
G.L. Vlaspolder1, B. Sanhaoui1, L.N. van Belzen1, P. Meijer2, A.N. Spaan1, C.H.E. Boel1
1Department of Medical Microbiology, University Medical Center Utrecht, Utrecht, 2Benelux department of Accelerate Diagnostics B.V., Leiden
Bloodstream infections caused by extended-spectrum-β-lactamase (ESBL)- and AmpC-producing Enterobacteriaceae are associated with high rates of morbidity and mortality. Because ESBL- and AmpC-producing bacteria are resistant to β-lactam antibiotics used for empiric treatment of infections, the empirical use of carbapenems has increased. As a consequence, an increasing rate of carbapenem resistance among gram-negative bacteria is seen. It is a challenge for every physician to empirically treat patients with ESBL-bacteremia with appropriate antibiotics and at the same time minimize unnecessary use of last-resort antibiotics in case of susceptible bacteria. Faster availability of susceptibility test results could allow pathogen-directed therapy to be started sooner. The Accelerate Pheno™ system (AxDx) is a fully automated system that provides MIC-based antimicrobial susceptibility testing (AST) results within seven hours, directly from positive blood cultures. This study was performed to determine the diagnostic accuracy of AST of the AxDx system for aminoglycosides and quinolones, in order to provide adequate therapy in a timely manner and to enable a de-escalation of treatment in susceptible bacteria. In total, 34 gram-negative isolates, of which 27 isolates consists of ESBL-producing bacteria, were analyzed on the AxDx system and compared to our standard of care (BD Phoenix, bioMérieux Vitek2, if necessary in combination with E-tests). The overall category agreement for aminoglycosides and quinolones was 92.7%. Of note, gentamycin, tobramycin, amikacin and ciprofloxacin resistance was correctly detected in ESBL-producing E. coli (n = 5). In conclusion, the AxDx system provides reliable results and is potentially useful for antimicrobial stewardship in patients with ESBL-bacteremia.
Improvement of survival of a Staphylococcus aureus sepsis after involvement of the antibiotic team and a bundle of interventions?
M.A.N.P.M. van den Hurk1, J. Fonville1, H. Ammerlaan2, C. Miedema3, S. Sanders4, I. Overdevest1
1Microbiology, PAMM, Veldhoven, 2Internal-infectiology, Catharina Hospital, Eindhoven, 3Pediatric-infectiology, Catharina Hospital, Eindhoven, 4Hospital Pharmacology, Catharina Hospital, Eindhoven
Staphylococcus aureus bacteraemia (SAB) is a serious clinical condition associated with a high mortality and complications such as seeding. Literature shows that a bundle of interventions improves the outcome of SAB significantly.1 Since 2013, our antibiotic team is increasingly involved in advising medical practitioners on treating patients with SAB. In this retrospective cohort study we evaluated the effect of the antibiotic team involvement and of bundle adherence on mortality and relapse SAB.
All adult patients (n = 179) with SAB admitted to the Catharina hospital Eindhoven between 2013-2015 were included. Thirty-one patients died < 14 days and were excluded. We retrospectively defined a bundle of interventions and scored compliance with the following measures; (1) involvement of the antibiotic team, including bedside consult of an infectious disease specialist; (2) follow-up blood cultures; (3) adequate antibiotic treatment; (4) source control; (5) TTE/TEE or PET-CT when increased risk of complicated infection.
Results showed improved survival rates and compliance to the bundle when the antibiotic team was involved advising the medical practitioners. The effects were especially observed with respect to adequate antibiotic treatment; 67% vs 52% (p = 0.08) and investigations on seeding in high risk patients; 72% vs 57% (p = 0.11). The risk on relapse SAB and mortality rates decreased from 21 to 10% (p = 0.11). We expect the results to be an underestimate considering the underlying bias where the antibiotic team is predominantly involved in the more severely ill patients.
This study shows a trend in improvement of surviving SAB and an added value of the antibiotic team.
Reference
1. Luis E. López-Cortés, Maria Dolores del Toro, Juan Gálvez-Acebal. Impact of an Evidence-Based Bundle: Intervention in the Quality-of-Care Management and Outcome of Staphylococcus aureus Bacteremia. Clin Inf Dis 2013:57;1225-33.
Data have recently been submitted for publication to the magazine Infectieziekten; the publication is still under consideration of the editorial board.
The tigecycline on the field: indications, efficacy, tolerability
A. Papaleo1, J. Prevost2, F. Jacobs2
1Internal Medicine and Infectious Diseases Department Hôpitaux Iris Sud, Brussels, Belgium, 2Infectious Diseases Department, Erasmus Hospital, Brussels, Belgium
Tigecycline could represent a valuable alternative to carbapenem and β-lactam based regimens. There are some data about real-life clinical practice from France, Germany, Italy, and Spain, but still no data about Belgium.
To investigate tigecycline prescription, tolerability and patients outcome we conducted a retrospective study in Erasmus Hospital, an 800-bed academic hospital in Brussels, between 2007 and 2015.
We included 89 patients. We observed a progressive increase in the prescription of tigecycline over years. The 60% of patients received tigecycline in intensive care unit (ICU), 35% had an immunosuppression, 23% had undergone solid organ transplantation. The main indications were pneumonia in 36% of cases and complicated intra-abdominal infections (28%) almost exclusively for healthcare-associated infections (98%). Tigecycline was used after documented infections in 92% of cases, 89% with multi-drug resistant (MDR) bacteria whose 78% carbapenemase-producing Enterobacteriaceae. The most isolated pathogen was Acinetobacter baumannii. We used tigecycline after multiple antibiotics in 85% of cases, only in 9% of infections as monotherapy and often associated with more than three antibiotics (43%). We recorded 8 secondary adverse events, but we never had to interrupt the treatment. Of 79 patients with enough data, 53% had clinical cure/improvement, 47% clinical failure and 75% of them died. Mortality rate in ICU was 45%, 71% during the entire hospitalization.
Tigecycline was mainly prescribed for pneumonia, in MDR infections or as rescue therapy in severely ill patients. Our data suggest a good tolerability and a need of tigecycline for different indications than approved by official authorities.
The use of Alpha-defensin (Synovasure©) in the diagnosis of periprosthetic joint infections
S. van Landeghem1, P. van Overschelde2, S. Steyaert1
1Clinical Laboratory, AZ Maria Middelares, Ghent, 2Hip and Knee clinic, AZ Maria Middelares, Ghent
Periprosthetic joint infection (PJI) is a major complication after total joint arthroplasty. According to the muskuloskeletal infection society (MSIS) criteria, a combination of clinical findings, culture and biomarkers have to be met to diagnose a PJI. This approach is resource and time consuming. The Synovasure (Zimmer) is a new lateral-flow test that is based on the detection of the anti-microbial peptide alpha-defensin in synovial fluid. To evaluate the performance in our general hospital a retrospective analysis is made during 01/03/2015 - 01/11/2016. Only samples with an alpha-defensin and a culture result are included and compared to the physicians’ investigation. Chocolate-, blood- and Mac Conckey agar is used for aerobic and anaerobic incubation during two days, a thioglycolate broth is incubated during five days. 43 results were included from 37 patients. All 15 (35%) positive and 28 (65%) negative tests matched MSIS criteria to confirm PJI or aseptic loosening. However, there were 7 (16%) discrepancies with culture. 2 (4.6%) false positive cultures were due to a contamination and a cyste, not connected to the joint. 5 (11.6%) patients had a false negative culture due to pre-operational antibiotics, low-grade infections or pus in the joint that didn’t result in an organism. The conclusion after multidisciplinary consultations is that synovasure had no discrepancies with the physicians’ clinical investigation in contrast to culture. Therefore synovasure is an interesting new biomarker to detect PJI and supports the choice between first and second stage revisions for prosthetic arthroplasty.
Non-invasive detection of prosthetic joint infections by multiplex antibody detection: Experiences in a tertiary care center
G. Frans1,* S. Ombelet1,2*, B. Peeters1,3, J. Neyt4, J. Verhaegen1
1Department of Laboratory Medicine, University Hospitals Leuven, Leuven, Belgium, 2Department of Tropical Laboratory Medicine, Institute of Tropical Medicine, Antwerp, Belgium, 3Department of Laboratory Medicine, University Hospital Antwerpen, Antwerp, Belgium, 4Department of Orthopedics, University Hospitals Leuven, Leuven, Belgium; *both authors contributed equally to this study
Current diagnostic algorithms for prosthetic joint infections (PJI) involve ESR or CRP testing, followed by joint aspiration if either is elevated. In this prospective study we evaluated the BJI InoPlex kit, a multiplex serological immunoassay documenting PJIs caused by Staphylococcus spp, Streptococcus agalactiae, and Propionibacterium acnes.
Patients who underwent revision or resection arthroplasty for suspected PJI between 18 March 2016 and 18 August 2017 at the University Hospitals Leuven were included. There were no exclusion criteria. Serum samples for immunoassay were taken at the time of surgery together with ≥3 intraoperative periprosthetic tissue samples for microbiological culture. PJI was defined by (i) the presence of a sinus tract and/or (ii) growth of a virulent organism in ≥1 intraoperative sample(s) or growthof the same nonvirulent microorganism in ≥2 intraoperative samples. Performance of the BJI InoPlex assay was evaluated with microbiological culture as reference.
A total of 56 serum and surgery samples from 49 patients (26 male and 23 female) were included with 16 hip, 31 knee, and 2 shoulder replacements. PJI was diagnosed in 38/56 samples (67.9%) corresponding with the identification of 47 microorganisms. In total, 85.1% (40/47) of infections involved at least one of the species included in the BJI InoPlex assay. The sensitivity/specificity values were 70.8%/71.0% for Staphylococcus spp (1/56 undetermined result), 83.3%/84.0% for Streptococcus spp, and 33.3%/88.7% for Propionibacterium spp.
Our results suggest that the BJI InoPlex assay could complement serological and microbiological screening in evaluating patients with suspected PJI.
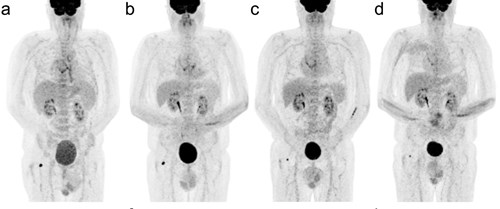
Cost-effectiveness of a screening program for chronic Q-fever in The Netherlands
P.T. de Boer1, M.L. de Lange1, C.C.H. Wielders1, F. Dijkstra1, P.M. Schneeberger2, W. van der Hoek1
1National Institute for Public Health and the Environment, Bilthoven, The Netherlands, 2Jeroen Bosch Hospital, ’s-Hertogenbosch, The Netherlands
In the aftermath of a large Q-fever outbreak in The Netherlands, new chronic Q-fever patients are still detected. A screening program may identify cases in an earlier stage, possibly resulting in a better prognosis. In this study, we assessed the cost-effectiveness of a serological screening program for chronic Q-fever.
A health-economic decision model was used to estimate the impact of screening on societal costs and health effects (measured as quality-adjusted life years [QALYs]). Prevalence of chronic Q-fever was estimated using Dutch prevalence studies of Coxiella burnetii infection and chronic Q-fever. The effect of screening on clinical outcomes was based on the national Q-fever database. Screening was considered cost-effective, when the incremental cost-effectiveness ratio was below a conventional threshold of € 20,000 per QALY gained.
Screening of patients with cardiovascular risk factors living in an area with high Q-fever incidence was expected to be cost saving. In this scenario, 215 QALYs would be gained and € 0.1 million would be saved. Moreover, screening of patients with cardiovascular risk factors living in moderate Q-fever incidence areas and patients with a compromised immune system living in high Q-fever incidence areas would be cost-effective. However, screening of patients without known risk factors would not be cost-effective. Results were found to be highly sensitive to the prevalence of chronic Q-fever.
Targeted screening programs for chronic Q-fever in areas with moderate to high Q-fever incidence might be cost-effective. However, there is much uncertainty on the current prevalence of chronic Q-fever and the effectiveness of screening on clinical outcomes.
Treating ESBLs with beta-lactams other than carbapenems
J. Mouton
Erasmus University Rotterdam
Since carbapenems are often the last defense against ESBL harbouring multi-drug resistant micro-organisms, other solutions need to be found. In the class of beta-lactams several alternative strategies are available. The first is to determine the activity of the ESBL against an array of beta-lactams. Most ESBLs are somewhat specific, and resistance to one beta-lactam does not necessarily imply resistance to others. In contrast to Amp-C they are not induced. The second strategy is to combine beta-lactams with each other, or a related compound. In general these can be divided in two groups. The first is combining a beta-lactam with a beta-lactamase inhibitor. Examples are an available beta-lactam such as cefepime combined with an existing beta-lactamase inhibitor such as tazobactam; a new beta-lactam combined with an existing inhibitor (e.g. ceftolozane-tazobactam; imipenem-relibactam) or an available betalactam combined with a new inhibitor (e.g. ceftazidime-avibactam; aztreonam-avibactam; meropenem-vaborbactam). The second group consists of a combination of two beta-lactams with distinct differences in affinity for various PBPs for instance PBP2 and PBP3 and thereby potentiating each other. An example here is cefepime with high affinity to PBP3 combined with zidebactam or mecillinam, both with binding almost exclusively to PBP2. For many of the current ESBLs at least one of these strategies will work and carbapenems be spared.
Monotherapy vs combination therapy; clinical results
A.E. Muller
Haaglanden MC, The Hague
With an increasing number of multi-drug resistant micro-organisms, combination therapy is often suggested as a solution for adequate therapy. More in general, the use of combination therapy can serve multiple purposes, such as empirically covering potential pathogens with a broader spectrum, differences in penetration of the site of infection or synergy between the two antibiotics. Some synergistic combinations are commercially developed in a fixed combination, for example amoxicillin/ clavulanic acid and trimethoprim/sulfamethoxazole. In the era of multi-drug resistance antibiotics usually administered as monotherapy are combined to achieve more effective treatment compared to monotherapy. This can be applied to micro-organisms reported susceptible to the specific antibiotics, but also for those reported resistant according to the clinical breakpoints. Unfortunately, although in vitro studies have indicated that several combinations of antibiotics are synergistic, proving this synergistic effect in clinical studies has appeared to be much more complicated. This can be explained by the complexity of patients involved in these studies. The outcome measures in these trials, such as mortality or length of hospital stay are influenced by many more factors than only antibiotic therapy. Meta-analyses have shown a benefit of combination therapy for patients with septic shock or for treatment of Pseudomonas aeruginosa infections. Interpretation of the results is often complicated by the difference between appropriate and inappropriate empiric therapies. Retrospective analyses are confounded. In recent publications, the beneficial effect of combination therapy on the mortality is still under debate and the effects are often limited to high risk patient groups.
Prosthetic joint infections
J. Geurts
Maastricht UMC, Adult Hip Reconstruction Infection Unit
There are a lot of controversies regarding the treatment of PJI (periprosthetic joint infection), certainly in the field or microbiological diagnosis and protocol. Also, many microbiologists are confronted with questions of their surgeons on a daily basis. It is therefore important to have good knowledge of the problem we are dealing with and what specific issues are making it a challenge. This presentation gives a current state of affairs concerning orthopaedic implant related infections, from definition to diagnosis to treatment.
Vascular prosthetic graft infections
B. Hasse
Division of Infectious Diseases and Hospital Epidemiology, University Hospital Zurich, University of Zurich, Zurich, Switzerland
Aortic graft infections (AGI) are associated with a high morbidity and mortality. With the advanced development and increasing use of endovascular techniques, also elderly patients with comorbidities receive reconstructive vascular surgery, whereby these comorbidities are adding on the risk of postsurgical infections. AGI can present in several ways, either as a local vessel erosion, gastrointestinal or bronchial bleeding, bacteraemia or fungemia or with normal physical findings. Treatment generally involves a redo surgery combined with antimicrobial therapy. The latter is very much dependent on the type of microorganism, graft location, involved graft material and most importantly on the surgical strategy (graft excision and extra-anatomic reconstruction; graft excision with in situ reconstruction; graft preservation and debridement; or no surgery). Based on the heterogeneity of all these factors, there are still many uncertainties with regard to type and length of antimicrobial therapy. The main aim of this session is to give an overview on the topic, and to discuss up-to-date microbiologic diagnostics in the field of AGI.
Parts of these data have been presented at ECCMID 2016 on April 9-12, Amsterdam.
Insights into newer antimicrobial agents active against multi-drug resistant gram-negative bacteria with a special focus on carbapenemase producers
Y. Glupczynsski
Department of Clinical Microbiology and National Reference Centre for Monitoring Antimicrobial resistance in Gram negative-bacteria, CHU UCL Namur, Mont-Godinne, Belgium
Multi-drug resistant (MDR) Gram-negative bacterial infections are widespread and increasing worldwide and they represent a critical threat as besides having the ability to escape the effect of antimicrobial drugs these organisms frequently lead to to increased mortality and morbidity (prolongation of length of hospitalization stay, increased diagnostic and treatment costs).
The Centers for Disease Control and Prevention has categorized carbapenem-resistant Enterobacteriaceae (CRE) as ‘urgent’ antibiotic threat in the USA where it estimated that these organisms account for more than 2 million infections, 23,000 deaths, and $2 billion in excess medical spending per year. In February 2017, the World Health Organization (WHO) also updated its list of Priority 1, critical organisms to include carbapenem-resistant and extended-spectrum beta-lactamases (ESBLs), carbapenem-resistant Enterobacteriaceae (CRE), carbapenem-resistant Pseudomonas aeruginosa, and carbapenem-resistant Acinetobacter baumannii.
In particular, carbapenemase-producing Enterobacteriaceae (CPE) produce different classes/families of plasmid-mediated carbapenemases (KPC, OXA-48, NDM, VIM,…), and more recently XDR CRE bacteria with plasmid-mediated resistance to colistin have been reported and may pose increasing threats in the future.
It is well known that the epidemiology of carbapenemases could vary appreciably between different continents and geographic areas and that it could also evolve rapidly locally. The spread of successful pandemic clones (i.e: ST258 KPC-producing K. pneumoniae) and/or the horizontal transfer of plasmids and transposons within and across different species (e.g: OXA-48 and NDM carbapenemases) has also led to the occurrence of major outbreaks in numerous countries over the last 5 years. Consequently also the worldwide advent and emergence of gram-negative superbugs has threatened the management of infections caused by these organisms with a drastic decrease in the list of antibiotics remaining active. In the early 2000s, the pharmaceutical industries solely focused on the development of antibacterial agents against MDR gram-positive bacteria (eg. methicillin-resistant S. aureus (MRSA) and vancomycin-resistant Enterococcus) with almost no significant development of drugs against gram-negative bacteria.
The development of new agents with activity against MDR gram-negative pathogens has accelerated over the last years and now provides (or will soon provide) new therapeutic options for clinicians. These new drugs include several beta-lactam/beta-lactamase inhibitors combinations (ceftazidime/avibactam, ceftolozane/tazobactam, imipenem/ciliastatin/relebactam, meropenem/vaborbactam and aztreonam/avibactam; other novel drugs active against MDR gram-negative in the pipeline and at an advancd stage of clinical development and belonging to other classes of antimicrobials also comprise eravacycline (tetracycline), plazomicin (aminoglycosides) as well as newer cephalosporin substrates such as cefiderocol, a siderophore cephalosporin with a catechol side chain).
Among the newer drugs in pipeline, two drugs (namely, ceftolozane/tazobactam (Zerbaxa) and ceftazidime/avibactam (Avycaz, Zavicefta)) have been approved by the FDA in 2015 and by the EMEA in 2016. The other drugs are in various phases of trials and some of them have reached or are closed to FDA approval in the US. Both ceftazidime/avibactam and ceftolozane/tazobactam mark the first combination of cephalosporins with beta-lactamase inhibitors. The two approved cephalosporin/beta-lactamase inhibitors combinations are bactericidal drugs (time-dependent killing) that inhibit bacterial cell wall synthesis by binding to penicillin-binding proteins. The major difference between these two drugs is their spectrum of bactericidal action. Ceftolozane/tabobactam acts on gram-negative bacteria (ESBL producing Enterobacteriaceae and P. aeruginosa) some anaerobes, and some gram-positive bacteria but does not act on any carbapenemases (i.e not active against CRE), while ceftazidime/avibactam has action only against gram-negative bacteria (Enterobacteriaceae and P. aeruginosa) and is the first cephalosporin/beta-lactam inhibitor combination having action against carbapenemases (mostly class A (e.g. KPC) and some class D (e.g. OXA-48) but not against any class B metallo-b-lactamases. Cefiderocol and ceftazidime/avibactam/aztreonam (while waiting for the aztronam/avibactam combination foreseen for 2020-2021) are promising options for metallo-b-lactamases and possibly also for multidrug-resistant P. aeruginosa, but definitive data showing clinical efficacy are as yet lacking. Reports of the development of resistance early after the release and use of new agents (as has already been observed for ceftazidime/avibactam) is of concern. Orally administered options and agents effective against Acinetobacter baumannii are underrepresented in clinical development. Time only will tell whether the newest approved antimicrobials as well as the other agents under development for Gram-negative infections will help to preserve or even enhance our existing armamentarium.